摘要:24.设反应①Fe(s)+CO2平衡常数K1; 反应②Fe(s)+H2O(g)⇋FeO+H2(g)平衡常数为K2 测得在不同温度下.K1.K2值如下: (1)若5000c时进行反应①.CO2起始浓度为2mol.L-1,CO2转化率为 . (2)9000c进行反应③H2(g)+CO2(g)⇋H2O,其平衡常数K3为 (3)反应②的焓变△H 0. (4)7000c反应②达到平衡.使得该平衡向右移动.其它条件不变时.可以采取的措施有 A.缩小反应器体积 B.加入水蒸气 C升高温度到9000c D.使用合适的催化剂 (5)下列图像符合反应①的是 (图中v是速率.∅为混合其中CO含量.T为温度)
网址:http://m.1010jiajiao.com/timu3_id_54269[举报]
设反应①Fe(S)+CO2(g)?FeO(S)+CO(g)的平衡常数为K1.反应②Fe(S)+H2O(g)?FeO(S)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可以推断:反应①是
(2)现有反应③H2(g)+CO2(g)?H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K3=
,
,.
(3)根据反应①与②,可推导出K1、K2与K3之间的关系式
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图1、2表示该反应③在时刻t1达到平衡、在时刻t2分别因改变某个条件而发生变化的情况:
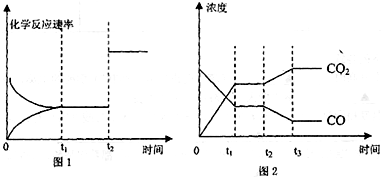
①图1中时刻t2发生改变的条件是
②图2中时刻t2发生改变的条件是
查看习题详情和答案>>
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
放
放
(填“吸”、“放”)热反应.(2)现有反应③H2(g)+CO2(g)?H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K3=
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
(3)根据反应①与②,可推导出K1、K2与K3之间的关系式
K3=
| K1 |
| K2 |
K3=
.据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应.问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有| K1 |
| K2 |
DF
DF
(填写序号).A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图1、2表示该反应③在时刻t1达到平衡、在时刻t2分别因改变某个条件而发生变化的情况:

①图1中时刻t2发生改变的条件是
增大压强或加入催化剂
增大压强或加入催化剂
②图2中时刻t2发生改变的条件是
降低温度或增大水蒸气的浓度或减小氢气的浓度,
降低温度或增大水蒸气的浓度或减小氢气的浓度,
.Ⅰ.设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可推断,反应①是
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.
根据反应①与②推导出K1、K2、K3的关系式K3=
;
可推断反应③是
A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:

(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
查看习题详情和答案>>
 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
吸
吸
(填“放”或“吸”)热反应.(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=
| k1 |
| k2 |
| k1 |
| k2 |
可推断反应③是
吸
吸
(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有DE
DE
.A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Q1-Q2
Q1-Q2
.Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
C
C
(填序号).A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
MnO4-
MnO4-
→Mn2+
Mn2+
.(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:


(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
0.6
0.6
mol.(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
KHCO3
KHCO3
.(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
.I.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.反应 ②Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)现有反应③CO2(g)+H2(g)?CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
Na2FeO2+ NaNO2+ H2O═ NaFeO2+ NH3↑+ NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.
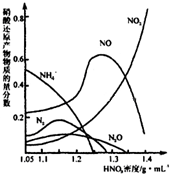
①图示可知,分析HNO3与铁反应的规律是 .
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 .
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.
查看习题详情和答案>>
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.

①图示可知,分析HNO3与铁反应的规律是
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.
设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(S)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)现有反应③H2(g)+CO2?CO(g)+H2O(g)△H=Q3根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
(2)已知1473K时,反应 CO2(g)+H2(g)?CO(g)+H2O(g) K=2.25.试根据下表中所列数据,通过计算确定反应可能进行的方向,并填写下列空白:
(3)反应FeO(s)+C(s)═Fe(s)+CO(g)△H>0,△S>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行
B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行
D.任何温度下均为自发进行.
查看习题详情和答案>>
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
Q1-Q2
Q1-Q2
,根据反应①与②推导出K1、K2、K3的关系式K3=| K1 |
| K2 |
| K1 |
| K2 |
(2)已知1473K时,反应 CO2(g)+H2(g)?CO(g)+H2O(g) K=2.25.试根据下表中所列数据,通过计算确定反应可能进行的方向,并填写下列空白:
| 各物质某一状态时的物质的量浓度/mol?L-1 | ||||||
| c(CO2) | c(H2 ) | c(CO) | c(H2O ) | Qc | 平衡 | |
| ① | 0.004 | 0.004 | 0.006 | 0.006 | 已达平衡 | |
| ② | 0.062 | 0.084 | 0.039 | 0.279 | 2.09 | |
| ③ | 0.182 | 0.086 | 0.098 | 0.359 | 2.25 | |
| ④ | 0.078 | 0.142 | 0.280 | 0.120 | 平衡逆向移动 | |
B
B
A.低温下自发进行,高温下非自发进行
B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行
D.任何温度下均为自发进行.
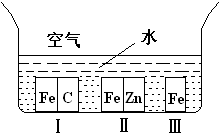 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是
(2)氟氯代烷是一种破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2;②O3→O+O2;③ClO→Cl+O2
上列反应的总反应式是
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松.试写出碳酸氢钠受热分解的化学方程式
(4)垃圾资源化的方法是
A、填埋 B、焚烧 C、堆肥法 D、分类回收法
B【供选学《化学反应原理》考生作答】
设反应①Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数为K1.反应②Fe(s)+H2O(g)═FeO(s)+H2(g)的平衡常数K2,在不同温度下,K1、K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③CO2(g)+H2(g)═CO(g)+H2O(g)写出该反应的平衡常数K3的数学表达式:K3═
(3)书写热化学方程式:
①1mol N2(g)与适量O2(g)起反应,生成NO2(g),吸收68KJ热量:
②NH3(g)燃烧生成NO2(g)和H2O(g),已知
(1)2H2(g)+O2(g)═2H2O(g)△H═-483.6kJ/mol
(2)N2(g)+2O2(g)═2NO2(g)△H═+67.8kJ/mol
1,N2(g)+3H2(g)═2NH3(g)△H═-92.0kJ/mol
NH3(g)燃烧生成NO2(g)和H2O (g)热化学方程式: