摘要:16. (1)①Mg +2OH- -2e- =Mg(OH)2↓ ②Al+4OH--3e-=AlO2-+2H2O 2H+ +2e- = H2↑(或 2H2O+2e- = H2↑+ 2OH-) (2)40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O
网址:http://m.1010jiajiao.com/timu3_id_48297[举报]
(2012?资阳二模)钛(Ti)被称为继铁、铝之后的第三大金属,我国四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
请回答下列问题:
(1)电解饱和食盐水时,总反应的离子方程式是
(2)写出钒钛磁铁矿经氯化法得到四氯化钛的化学方程式:
(3)已知:①Mg(s)+Cl2(g)═MgCl2(s)△H=-641kJ/mol
②Ti(s)+2Cl2(g)═TiCl4(s)△H═-770kJ/mol
下列说法正确的是
a.Mg的燃烧热为641kJ/mol
b.Ti的能量一定比TiCl4的高
c.等质量的Mg(S)、Ti(S)与足量的氯气反应,前者放出的热量多
d.MG还原TiCl4的热化学方程式为2Mg(S)+TiCl4(s)═2MgCl2(S)+Ti(s)△H=-512kJ/mol
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
查看习题详情和答案>>

请回答下列问题:
(1)电解饱和食盐水时,总反应的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
(2)写出钒钛磁铁矿经氯化法得到四氯化钛的化学方程式:
2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO
| ||
2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO
.
| ||
(3)已知:①Mg(s)+Cl2(g)═MgCl2(s)△H=-641kJ/mol
②Ti(s)+2Cl2(g)═TiCl4(s)△H═-770kJ/mol
下列说法正确的是
CD
CD
(填字母).a.Mg的燃烧热为641kJ/mol
b.Ti的能量一定比TiCl4的高
c.等质量的Mg(S)、Ti(S)与足量的氯气反应,前者放出的热量多
d.MG还原TiCl4的热化学方程式为2Mg(S)+TiCl4(s)═2MgCl2(S)+Ti(s)△H=-512kJ/mol
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2
10
10
t.(不考虑生产过程中物质的任何损失)(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
2CH3OH-12e-+16OH-=2CO32-+12H2O
2CH3OH-12e-+16OH-=2CO32-+12H2O
.为除去粗盐中的少量Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)加入过量BaCl2溶液的目的是除去粗盐中的
(2)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为
查看习题详情和答案>>

(1)加入过量BaCl2溶液的目的是除去粗盐中的
除去粗盐中的除去粗盐中的SO42+
除去粗盐中的除去粗盐中的SO42+
(填化学式).(2)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为
Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
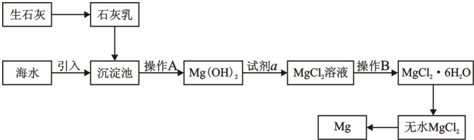
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
(3)操作A是
(4)加入的足量试剂a是
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
查看习题详情和答案>>

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
,写出在沉淀池的离子方程式Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
贝壳
贝壳
.(3)操作A是
过滤
过滤
,操作B是加热浓缩
加热浓缩
.(4)加入的足量试剂a是
HCl
HCl
(填化学式).(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.从考虑成本和废物循环利用的角度,副产物氯气可以用于
| ||
制盐酸,循环使用
制盐酸,循环使用
.(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
且成本低.
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
.且成本低.
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
不同意
不同意
(填“同意”或“不同意”)该同学的想法,理由是MgO熔点很高,熔融时耗费大量的能量而增加生产成本
MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源.液体矿床以钾矿为主,伴生着镁、溴等多种矿产.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:

 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:
(1)操作①的名称是:
操作④需要的玻璃仪器有:
(2)
(3)同学甲提出一些新的方案,对上述操作②后
无色溶液进行除杂提纯,其方案如下:
(有关资料)
(设计除杂过程)

(i)若在操作⑤结束后发现溶液B略有浑浊,应采取的措施是
(ii)写出混合液a加入到无色溶液中发生的离子反应方程式:
(检验除杂效果)
(ⅲ)为检验Mg2+、SO42-是否除尽,通常分别取悬浊液A上层清液于两试管中.进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中最好加入某溶液X,如果没有沉淀生成,表明Mg2+已除尽.
步骤二:检验SO42-是否除尽.向另一支试管中加入某溶液Y,如果没有沉淀生成,则SO42-已除尽.则溶液X、Y分别是
A、K2CO3、BaCl2 B、KOH、BaCl2 C、Ba(OH)2、CaCl2
(获取纯净氯化钾)
(ⅳ)对溶液B加热并不断滴加l mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.
(ⅴ)将溶液C倒入
(问题讨论)
(ⅵ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度
查看习题详情和答案>>

 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:(1)操作①的名称是:
萃取
萃取
;操作④需要的玻璃仪器有:
玻璃棒、漏斗、烧杯
玻璃棒、漏斗、烧杯
.(2)
KCl
KCl
(3)同学甲提出一些新的方案,对上述操作②后
无色溶液进行除杂提纯,其方案如下:
(有关资料)
| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |

(i)若在操作⑤结束后发现溶液B略有浑浊,应采取的措施是
更换滤纸、重新过滤
更换滤纸、重新过滤
;(ii)写出混合液a加入到无色溶液中发生的离子反应方程式:
Ba2++SO42-═BaSO4↓、2OH-+Mg2+═Mg(OH)2 ↓;
Ba2++SO42-═BaSO4↓、2OH-+Mg2+═Mg(OH)2 ↓;
试剂b的化学式是K2CO3
K2CO3
.(检验除杂效果)
(ⅲ)为检验Mg2+、SO42-是否除尽,通常分别取悬浊液A上层清液于两试管中.进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中最好加入某溶液X,如果没有沉淀生成,表明Mg2+已除尽.
步骤二:检验SO42-是否除尽.向另一支试管中加入某溶液Y,如果没有沉淀生成,则SO42-已除尽.则溶液X、Y分别是
B
B
.A、K2CO3、BaCl2 B、KOH、BaCl2 C、Ba(OH)2、CaCl2
(获取纯净氯化钾)
(ⅳ)对溶液B加热并不断滴加l mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.
(ⅴ)将溶液C倒入
蒸发皿
蒸发皿
(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体,剩余较少水时
出现较多晶体,剩余较少水时
,停止加热.(问题讨论)
(ⅵ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度
1.6×10-7mol/L
1.6×10-7mol/L
.