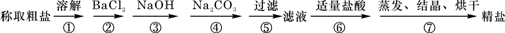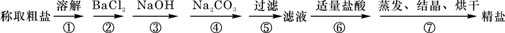题目内容
为除去粗盐中的少量Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)加入过量BaCl2溶液的目的是除去粗盐中的
(2)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为

(1)加入过量BaCl2溶液的目的是除去粗盐中的
除去粗盐中的除去粗盐中的SO42+
除去粗盐中的除去粗盐中的SO42+
(填化学式).(2)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为
Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.分析:(1)发生离子反应:Ba2++SO42-═BaSO4↓;
(2)氯化镁和氢氧化钠反应生成氢氧化镁难溶物.
(2)氯化镁和氢氧化钠反应生成氢氧化镁难溶物.
解答:解 (1)利用反应:Ba2++SO42-═BaSO4↓,加入过量BaCl2溶液,除掉粗盐中的硫酸根离子;
故答案是:除去粗盐中的除去粗盐中的SO42+;
(2)镁离子和氢氧根离子生成硫酸钡沉淀,反应的离子方程式为Mg2++2OH-═Mg(OH)2↓,
故答案是:Mg2++2OH-═Mg(OH)2↓.
故答案是:除去粗盐中的除去粗盐中的SO42+;
(2)镁离子和氢氧根离子生成硫酸钡沉淀,反应的离子方程式为Mg2++2OH-═Mg(OH)2↓,
故答案是:Mg2++2OH-═Mg(OH)2↓.
点评:本题考查的是粗盐的提纯,涉及的问题比较简单,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
(12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):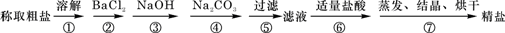
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)步骤2中,判断加入BaCl2已过量的方法是:
(3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答) 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
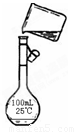
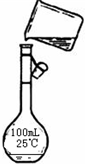
(5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是: 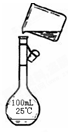
(6)配制过程中,下列操作情况会使结果偏低的是
| A.称量时,托盘天平左盘加砝码,右盘加氯化钠 |
| B.移液前,容量瓶中有少量蒸馏水未倒出 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |


 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):