摘要:5.用惰性电极电解1 L足量KCl的溶液.若通过n mol电子的电量.则溶液的pH与n的关系是(设电解前后溶液的体积不变) A.pH= lg n B.pH=-lg n C.pH=14+lgn D.pH=lgn-14
网址:http://m.1010jiajiao.com/timu3_id_48244[举报]
|
用惰性电极电解1 L足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变) | |
A. |
pH=n |
B. |
pH=-lgn |
C. |
pH=14-lgn |
D. |
pH=lgn+14 |
用惰性电极电解1 L足量KCl的溶液,若通过nmol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变)
- A.pH=n
- B.pH=-lgn
- C.pH=14-lgn
- D.pH=lgn+14
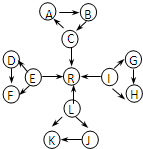 元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):已知:
①图中每个小三角形的三种物质中至少含有一种相同元素,A与B、D与F、K与J均由2种相同的元素组成.
②C、E、L、I为常见固体单质,C、E、L都能与水在一定条件下反应生成气体单质R,D、F中所含的非金属元素所形成的单质常温下为黄绿色气体.其余物质为常见化合物.
③K为淡黄色固体.
④C、L、I三元素原子的原子序数之和为30.
根据以上信息,回答下列问题:
(1)写出R的名称
氢气
氢气
,K的电子式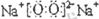
(2)请些出由B生成C的化学反应方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(3)I和氢氧化钠溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;I和氢氧化钠溶液反应除生成R还可以得到H.请用离子方程式表示H水溶液呈碱性的原因:AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(4)用惰性电极电解一定浓度足量的L的氯化物水溶液,若电解结束时,通过电子为0.2mol,电解后恢复至室温,溶液的体积为2L,则溶液的pH为
13
13
.(5)若D溶液中含有杂质F,如何除去?
若D为FeCl2,则通入足量的Cl2即可.若D为FeCl3,则加入足量的Fe,再过滤
若D为FeCl2,则通入足量的Cl2即可.若D为FeCl3,则加入足量的Fe,再过滤
.
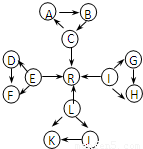
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
已知:
①图中每个小三角形的三种物质中至少含有一种相同元素,A与B、D与F、K与J均由2种相同的元素组成.
②C、E、L、I为常见固体单质,C、E、L都能与水在一定条件下反应生成气体单质R,D、F中所含的非金属元素所形成的单质常温下为黄绿色气体.其余物质为常见化合物.
③K为淡黄色固体.
④C、L、I三元素原子的原子序数之和为30.
根据以上信息,回答下列问题:
(1)写出R的名称 ,K的电子式 .
(2)请些出由B生成C的化学反应方程式 .
(3)I和氢氧化钠溶液反应的离子方程式 ;I和氢氧化钠溶液反应除生成R还可以得到H.请用离子方程式表示H水溶液呈碱性的原因: .
(4)用惰性电极电解一定浓度足量的L的氯化物水溶液,若电解结束时,通过电子为0.2mol,电解后恢复至室温,溶液的体积为2L,则溶液的pH为 .
(5)若D溶液中含有杂质F,如何除去? .
 查看习题详情和答案>>
查看习题详情和答案>>
已知:
①图中每个小三角形的三种物质中至少含有一种相同元素,A与B、D与F、K与J均由2种相同的元素组成.
②C、E、L、I为常见固体单质,C、E、L都能与水在一定条件下反应生成气体单质R,D、F中所含的非金属元素所形成的单质常温下为黄绿色气体.其余物质为常见化合物.
③K为淡黄色固体.
④C、L、I三元素原子的原子序数之和为30.
根据以上信息,回答下列问题:
(1)写出R的名称 ,K的电子式 .
(2)请些出由B生成C的化学反应方程式 .
(3)I和氢氧化钠溶液反应的离子方程式 ;I和氢氧化钠溶液反应除生成R还可以得到H.请用离子方程式表示H水溶液呈碱性的原因: .
(4)用惰性电极电解一定浓度足量的L的氯化物水溶液,若电解结束时,通过电子为0.2mol,电解后恢复至室温,溶液的体积为2L,则溶液的pH为 .
(5)若D溶液中含有杂质F,如何除去? .
 查看习题详情和答案>>
查看习题详情和答案>>
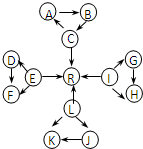 元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):
元素及其化合物是中学化学的主干知识,我们在整理元素化合物之间的相互转化时,发现有些物质间存在如图所示的三角转化关系(部分反应物或生成物已略去):