摘要:24. A.B.C.D.E.F.G.H.I.J均为有机化合物.根据以下框图.回答问题: (1)B和C均为有支链`的有机化合物.B的结构式为 ,C在浓硫酸作用下加热反应只能生成一种烯烃D.D的结构简式为 . (2)G能发生银镜反应.也能使溴的四氯化碳溶液褪色.则G的结构简式为 (3)写出⑤的化学反应方程式 . ⑨的化学反应方程式 . (4)①的反应类型 .④的反应类型 .⑦的反应类型 . (5)与H具有相同官能团的H的同分异构体的结构简式为 . 答案:(1). (2) (3) (4)水解.取代.氧化 (5)CH3CH=CHCOOH CH2=CHCH2COOH
网址:http://m.1010jiajiao.com/timu3_id_47540[举报]
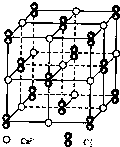 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2时成对电子;E+原子核外有3层电子且M层3d轨道电子全充满.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2时成对电子;E+原子核外有3层电子且M层3d轨道电子全充满.请回答下列问题:(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为
(5)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为
A、B、C、D、E为前20号元素,原子序数依次增大,其中A、D同主族,B、C、D同周期,B、C、D最高价氧化物对应的水化物均能相互反应生成盐和水.A、B、E的单质均能和水剧烈反应,E+与D的阴离子具有相同的电子层结构.
(1)A、B、C、D四种元素的原子半径由小到大的顺序是 (用元素符号表示).
(2)A和D的氢化物中 (用化学式表示)的沸点较高,原因是 .
(3)写出E单质与水反应的离子方程式 .
(4)B和D形成的晶体中,每个阳离子与它最近且等距的阳离子共有 个.
查看习题详情和答案>>
(1)A、B、C、D四种元素的原子半径由小到大的顺序是
(2)A和D的氢化物中
(3)写出E单质与水反应的离子方程式
(4)B和D形成的晶体中,每个阳离子与它最近且等距的阳离子共有
[化学--选修3:物质结构与性质]
有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,A,E同主族,且A元素的质子数是E元素的一半.最外层电子数D元素原子是A元素原子的一半,核外电子数C元素原子比E元素原子少5个.
(1)基态D元素原子的电子排布式为 .A与B相比,电负性较大的是 (用相应的元素符号表示.下同).EA3分子的立体构型为 ,在该分子中,中心原子E采用的杂化轨道类型是 .
(2)A的氢化物沸点高于E的氢化物的沸点,原因是 .
(3)B和C所形成化俣物中存在的化学键是 ,其晶体稳定性高于NaCl晶体,原因是 .
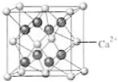 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是 ,该化合物的化学式是 .
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是 ,该化合物的化学式是 .
查看习题详情和答案>>
有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,A,E同主族,且A元素的质子数是E元素的一半.最外层电子数D元素原子是A元素原子的一半,核外电子数C元素原子比E元素原子少5个.
(1)基态D元素原子的电子排布式为
(2)A的氢化物沸点高于E的氢化物的沸点,原因是
(3)B和C所形成化俣物中存在的化学键是
 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是A、B、C、D、E是五种原子序数依次递增的短周期主族元素,已知:其中只有一种是金属素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素的原子质子数的2倍;B的最外层电子数是电子层数的2倍;C、A可形成二种常见的液态化合物甲和乙,且相对分子质量乙比甲大16.
(1)E元素的名称: ;D的原子结构示意图:
(2)化合物乙中含有的化学键: ;
(3)A单质与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,从原子经济角度,应选用B、C的化合物是 (填化学式);
已知CO(g)+
O2(g)═CO2(g);△H=-283KJ/mol
H2(g)+
O2(g)═H2O(g)△H=-242KJ/mol
CH3OH(g)+
O2+2H2O(g)═CO2(g)+2H2O;△H=-651KJ/mol 写出A与所选化合物合成甲醇的热化学方程式: .
(4)EC2与C、D形成化合物发生氧化一还原反应的化学方程式: .
查看习题详情和答案>>
(1)E元素的名称:
(2)化合物乙中含有的化学键:
(3)A单质与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,从原子经济角度,应选用B、C的化合物是
已知CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
CH3OH(g)+
| 3 |
| 2 |
(4)EC2与C、D形成化合物发生氧化一还原反应的化学方程式:
A、B、C、D、E、F为原子序数依次增大的同一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E.G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为 .
(2)D的原子结构示意图为 .
(3)用电子式表示出B、F形成化合物的过程: .
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答).
(5)实验室制备G的氢化物的化学方程式: .
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是 .
②相应的化学方程式: .
查看习题详情和答案>>
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的过程:
(4)以上元素中原子半径最大的是
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式: