摘要:海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来.既可以解决淡水资源缺乏的问题.又可以充分利用海洋资源. (1)海水中含有大量的氯化钠.氯化钠中的金属元素位于元素周期表第 族. (2)目前国际上实用的“海水淡化 主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽.蒸汽经过冷却而得高纯度淡水.由此可判断蒸馏法是 (3)工业上利用电解饱和食盐水可制得重要化工产品.反应式为: 食盐+H2O NaOH+H2+Cl2.该反应中食盐的化学式是 .利用电解所得气体制36.5%的浓盐酸1000t.最少需要消耗食盐 t. 吸收 (4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法.该方法的流程如下: 写出②④的化学反应方程式: 上述亚硫酸氢钠与甲醛经过一定反应.可以合成俗称“吊白块 的物质.因吊白块对人体有害.不能用于食品漂白.其结构简式为:HOCH2SO3Na.根据其结构特点.吊白块能发生的反应有: A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
网址:http://m.1010jiajiao.com/timu3_id_47354[举报]
(2013?哈尔滨模拟)[化学--选修化学与技术]
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4%,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,如图是某工厂对海水资源综合利用的示意图:
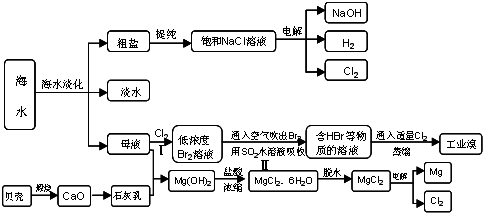
(1)请列举海水淡化的两种方法
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(4)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
(5)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
(6)苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
查看习题详情和答案>>
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4%,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,如图是某工厂对海水资源综合利用的示意图:

(1)请列举海水淡化的两种方法
蒸馏法
蒸馏法
、电渗析法
电渗析法
.(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
CH2=CHCOONa
CH2=CHCOONa
.(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:
富集溴元素
富集溴元素
.步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
Br2+SO2+2H2O═4H++SO2-4+2Br-
Br2+SO2+2H2O═4H++SO2-4+2Br-
(4)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O受热产生的水汽,故能得到无水MgCl2
.(5)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A
A
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
(6)苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
苦卤样品体积、加入NaOH溶液后生成Mg(OH)2的质量、加入BaCl2溶液后生成BaSO4的质量
苦卤样品体积、加入NaOH溶液后生成Mg(OH)2的质量、加入BaCl2溶液后生成BaSO4的质量
.海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.试回答下列问题:
(1)海水中含有大量的氯化钠.氯化钠中的金属元素化合价为
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:

写出①③的化学反应方程式:
查看习题详情和答案>>
(1)海水中含有大量的氯化钠.氯化钠中的金属元素化合价为
+1
+1
.(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化)(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是
NaCl
NaCl
.利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5
58.5
t.(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:

写出①③的化学反应方程式:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
,
| ||
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.请回答下列问题:
(1)目前,以下“技术”中,可用于“海水淡化”的是 (填序号).
①蒸馏法 ②膜分离法(电渗析、反渗透) ③冷冻法 ④离子交换法
(2)海水晒盐利用的化学原理是 ;分离食盐晶体后的母液中含有 ,经过分离、提纯后,可用于 .
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的离子方程式为: ;电解所用的食盐水
需要精制,其原因是 ;精制时所用试剂为:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液.加入试剂时,Na2CO3溶液必须在加入 之后加入.
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:

写出反应②的化学方程式: .
查看习题详情和答案>>
(1)目前,以下“技术”中,可用于“海水淡化”的是
①蒸馏法 ②膜分离法(电渗析、反渗透) ③冷冻法 ④离子交换法
(2)海水晒盐利用的化学原理是
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的离子方程式为:
需要精制,其原因是
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:

写出反应②的化学方程式:
海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
(1)海水中含有大量的氯化钠.请写出氯原子的原子结构示意图
 ;
;
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.电解饱和食盐水的化学方程式为
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:试写出④的化学反应方程式

查看习题详情和答案>>
(1)海水中含有大量的氯化钠.请写出氯原子的原子结构示意图


(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化);(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.电解饱和食盐水的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:试写出④的化学反应方程式
NaHSO3+HCl=NaCl+SO2↑+H2O
NaHSO3+HCl=NaCl+SO2↑+H2O
.
海洋是非常巨大的资源宝库,海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
(1)海水中存在大量的氯化钠,氯化钠的电子式
 .
.
(2)目前,国际上实际采用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变为蒸汽,蒸汽经冷却而得高纯度淡水.由此可判断蒸馏法是
(3)从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是
①加适量的KI溶液
②通入溴蒸气
③加入适量的NaOH溶液
④加入适量的NaBr溶液
(4)工业上利用电解饱和食盐水可制得重要化工产品.反应式为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,该反应的离子方程式为
查看习题详情和答案>>
(1)海水中存在大量的氯化钠,氯化钠的电子式


(2)目前,国际上实际采用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变为蒸汽,蒸汽经冷却而得高纯度淡水.由此可判断蒸馏法是
物理变化
物理变化
(填“物理变化”或“化学变化”).(3)从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是
④
④
(填序号).①加适量的KI溶液
②通入溴蒸气
③加入适量的NaOH溶液
④加入适量的NaBr溶液
(4)工业上利用电解饱和食盐水可制得重要化工产品.反应式为:2NaCl+2H2O
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
,该反应从能量转化上分析应属于
| ||
电能转化为化学能
电能转化为化学能
;利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐58.5
58.5
t.