题目内容
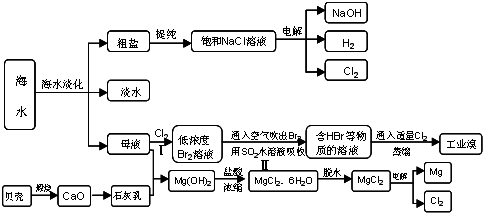
海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.试回答下列问题:
(1)海水中含有大量的氯化钠.氯化钠中的金属元素化合价为
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:

写出①③的化学反应方程式:
(1)海水中含有大量的氯化钠.氯化钠中的金属元素化合价为
+1
+1
.(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化)(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是
NaCl
NaCl
.利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5
58.5
t.(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:

写出①③的化学反应方程式:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
,
| ||
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
分析:(1)依据氯化钠中元素组成结合原子结构分析元素化合价;
(2)根据蒸馏法的原理;
(3)食盐是氯化钠,食盐的化学式为NaCl;依据化学方程式计算应用.
(4)流程分析判断,电解氯化钠溶液得到氢氧化钠、氢气、氯气;注意反应条件的书写;氢气和氯气光照或加热反应生成氯化氢.
(2)根据蒸馏法的原理;
(3)食盐是氯化钠,食盐的化学式为NaCl;依据化学方程式计算应用.
(4)流程分析判断,电解氯化钠溶液得到氢氧化钠、氢气、氯气;注意反应条件的书写;氢气和氯气光照或加热反应生成氯化氢.
解答:解:(1)氯化钠中 的钠元素原子最外层电子是1,失去最外层电子化合价为+1价,故答案为:+1;
(2)由于蒸馏法只是水的状态由液态到气态再到液态的过程,所以属于物理变化;故答案为:物理变化;
(3)电解饱和食盐水反应的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;食盐为氯化钠,NaCl;
H2+Cl2=2HCl;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;假设反应过程中无损耗,生成的氢气和氯气全部生成氯化氢,则依据元素守恒可知氯化钠中的氯元素全部转化为氯化氢中的氯元素,依据守恒计算得到:用电解所得气体制36.5%的浓盐酸100t,氯化氢质量为36.5t,NaCl~HCl,最少需要消耗食盐58.5t;
故答案为:NaCl;58.5;
(4)反应①是电解饱和食盐水的反应生成氢气、氯气、氢氧化钠,反应的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
反应③是氢气和氯气反应生成氯化氢,反应的化学方程式为:H2+Cl2
2HCl;
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;H2+Cl2
2HCl.
(2)由于蒸馏法只是水的状态由液态到气态再到液态的过程,所以属于物理变化;故答案为:物理变化;
(3)电解饱和食盐水反应的化学方程式为:2NaCl+2H2O
| ||
H2+Cl2=2HCl;2NaCl+2H2O
| ||
故答案为:NaCl;58.5;
(4)反应①是电解饱和食盐水的反应生成氢气、氯气、氢氧化钠,反应的化学方程式为:2NaCl+2H2O
| ||
反应③是氢气和氯气反应生成氯化氢,反应的化学方程式为:H2+Cl2
| ||
故答案为:2NaCl+2H2O
| ||
| ||
点评:本题考查了饱和食盐水的电解原理应用,产物判断和有关计算,化学方程式的书写,题目较简单.

练习册系列答案
相关题目