摘要:25.钢铁工业是国家工业的基础.2006年我国粗钢产量突破4亿吨.居世界首位. 某中学社会实践活动小组利用假期对当地钢铁厂进行了调研.对从矿石开始到钢铁产出的工 艺流程有了全面的感性认识.请您对社会实践活动小组感兴趣的问题进行计算: (1)将6.62 g铁矿石样品投入适量的盐酸中.过滤.然后在滤液中加过量的NaOH 溶液. 充分反应后.过滤.洗涤.灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁.若生产过程中铁 元素损失4%.计算每生产1.00t生铁.至少需要这种铁矿石多少吨? (2)取某钢样粉末28.12g.在氧气流中充分反应.得到CO2气体224mL. ① 计算此钢样粉术中铁和碳的物质的量之比. ②再取三份不同质量的钢样粉末 分别加到100mL相通浓度的H2SO4溶液中.充分反 应后. 测得的实验数据如下表所示: 计算硫酸溶液的物质的量浓度. ③若在实验Ⅱ中继续加入mg钢样粉末.计算反应结束后剩余的固体质量为多少?
网址:http://m.1010jiajiao.com/timu3_id_47059[举报]
钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.
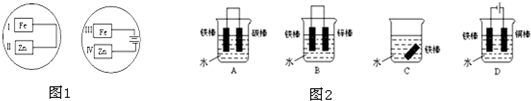
(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差
查看习题详情和答案>>

(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是
Ⅰ、Ⅳ
Ⅰ、Ⅳ
(填I、II、III、IV),写出II处电极的电极反应式:Zn-2e-=Zn2+
Zn-2e-=Zn2+
;写出IV处电极的电极反应式:2H++2e-=H2↑
2H++2e-=H2↑
;写出该两种情况下发生的总反应的离子方程式:2Fe+O2+H2O=2Fe(OH)2
2Fe+O2+H2O=2Fe(OH)2
;Fe+2H2O
Fe(OH)2+H2↑
| ||
Fe+2H2O
Fe(OH)2+H2↑
.若把III的铁片改为碳棒,写出该处发生的电极反应式:
| ||
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是
ACBD
ACBD
(填字母)
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是
AB
AB
(填字母)A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是
铁
铁
(写元素名称),A电极的电极反应式是Cu-2e-=Cu2+
Cu-2e-=Cu2+
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差
12.8
12.8
g.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: .
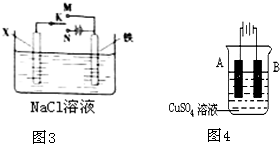
(2)下列图1哪个装置可防止铁棒被腐蚀 .
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.
装置示意图如2:请回答:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是: .
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为 mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
查看习题详情和答案>>
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
(2)下列图1哪个装置可防止铁棒被腐蚀

(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.
装置示意图如2:请回答:
①A电极对应的金属是
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:
Ⅱ.某同学利用CuSO4溶液,进行以下实验探究.
①图1是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池.Cu极的电极反应式是
②图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
查看习题详情和答案>>
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
下列哪个装置示意图可防止铁棒被腐蚀BD
BD
.
Ⅱ.某同学利用CuSO4溶液,进行以下实验探究.
①图1是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池.Cu极的电极反应式是
Cu 2++2e-═Cu
Cu 2++2e-═Cu
,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向乙
乙
移动(填“甲”或“乙”).②图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
O2
O2
(填“CH4”或“O2”),a处电极上发生的电极反应式是CH4-8e-+10OH-═CO32-+7H2O
CH4-8e-+10OH-═CO32-+7H2O
;当铜电极的质量变化3.2g,则消耗的CH4在标准状况下的体积为0.28
0.28
L.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
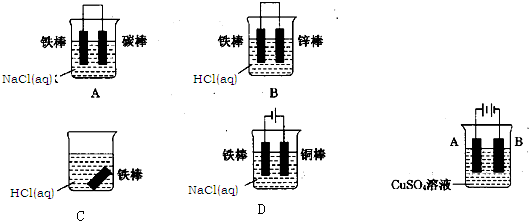
(1)生产中可用盐酸中除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,发生的化合反应的化学方程式为
(2)下列哪种装置中防止铁棒被腐蚀
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示:请回答:
①A电极对应的金属是
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为
查看习题详情和答案>>

(1)生产中可用盐酸中除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,发生的化合反应的化学方程式为
2FeCl3+Fe=3FeCl2
2FeCl3+Fe=3FeCl2
(2)下列哪种装置中防止铁棒被腐蚀
BD
BD
.(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示:请回答:
①A电极对应的金属是
Cu
Cu
(写元素符号),B电极的电极反应是Cu2++2e-=Cu
Cu2++2e-=Cu
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为
0.08
0.08
mol.Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:

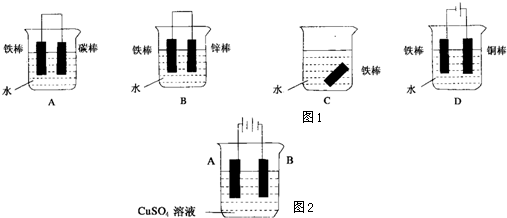
Ⅱ.某小组为研究电化学原理,设计如图2的装置.请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为
(2)a和b用导线连接时,外电路中的电子是从
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的
查看习题详情和答案>>
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;图1中哪个装置示意图可防止铁棒被腐蚀BD
BD
.
Ⅱ.某小组为研究电化学原理,设计如图2的装置.请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
,此时能量转化形式主要是化学能转化为热
热
能.(2)a和b用导线连接时,外电路中的电子是从
Fe
Fe
电极流出(填“Fe”或“Cu”),SO42-
SO42-
(填Cu2+或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为Cu2++2e-=Cu
Cu2++2e-=Cu
.(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的
正
正
(填“正极”或“负极”)连接;此时铜片上发生的电极反应式为Cu-2e-=Cu2+
Cu-2e-=Cu2+
.