摘要:用绳索将小船拉向岸边.如右图所示.设船在水中运动时水的阻力大小不变.那么在小船匀速靠岸的过程中.下列说法正确的是 A.绳子的拉力T不断增大 B.绳子的拉力 T 不变 C.船的浮力不变 D.船的浮力增大
网址:http://m.1010jiajiao.com/timu3_id_46805[举报]
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:I. 取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3].
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状.
Ⅲ.按如图所示装置连接仪器、检查气密性、装入化学试剂.
(1)过程I发生反应的离子方程式是
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
.(2)写出过程Ⅲ中检查气密性的方法
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
.(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是
产生红棕色气体
产生红棕色气体
,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开
轻轻将注射器活塞向右拉使铜丝和溶液分开
,关闭a,取下注射器.②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生.稀硝酸充满玻璃管的实验目是
将玻璃管中的NO2和空气排出
将玻璃管中的NO2和空气排出
,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致.结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管的
| ||
| 2 | 50 | 不足试管的
| ||
| 3 | 0 | 液面上升超过实验1 |
低
低
(填“高”或“低”),进入试管中的溶液越多.②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2=HNO3+2NO↑+H2O;
b.HNO2不稳定.
则产生上述现象的原因是
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
. I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.
I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.(1)测量鳔内气体的体积.小明设计了两种方法:
A:用医用注射器抽取鳔内气体,测量其体积.
B:在水下刺破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
你认为其中测量结果不准确的一种方法是
B
B
,(选填A或B)与理由有关的化学方程式是C02+H2O═H2CO3
C02+H2O═H2CO3
.(2)探究鳔内气体的成分.现有两集气瓶的鳔内气体,请你帮助小明设计实验进行验证.
| 实验目的 | 实验方法 | 实验现象 |
| 验证鳔内含O2 | ||
| 验证鳔内含CO2 |
(1)定性分析:如图甲可通过观察
反应产生气泡的快慢
反应产生气泡的快慢
,定性比较得出结论.但有同学说这个结论不合理,他认为不合理的理由是阴离子不相同,无法排除阴离子的干扰;
阴离子不相同,无法排除阴离子的干扰;
.(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验 的因素均已忽略.检查该装置气密性的方法是
关闭分液漏斗的活塞,将注射器活塞向外拉出一小段,松手后看其是否回到原位
关闭分液漏斗的活塞,将注射器活塞向外拉出一小段,松手后看其是否回到原位
,实验中需要测量的数据是收集40mL气体所需要的时间
收集40mL气体所需要的时间
.
已知氯水中有如下平衡:Cl2+H2O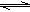 HCl+HClO,常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
HCl+HClO,常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
(1)针筒中可观察到的现象是___
________________。
(2)若将此针筒长时间放置在有日光的地方,最终可观察到的现象是_____________。
(3)用化学平衡的观点解释上题中的现象:_____
_________________________________。
(4)在该针筒内吸入NO2和N2O4的混合气体,如果将活塞迅速往上推,对气体进行压缩,观察到的现象为________________;如果将活塞迅速向下拉,观察到的现象为___________________。

某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质.

(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤,回答下列问题:
(1)竖直冷凝管冷凝水流向 口进 口出,竖直冷凝管冷凝的作用 .
(2)制备操作中,加入的少量的水,其目的是 ;(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)该实验装置中 装置可防止倒吸,中学化学实验中 用此方法防止倒吸.
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等:检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是 、 .
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是 .(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用如图2实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL 6mol/L NaOH溶液和2mL溴乙烷,振荡.
Ⅱ:将试管如图2固定后,水浴加热.
(6)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应.
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 .
查看习题详情和答案>>

(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤,回答下列问题:
(1)竖直冷凝管冷凝水流向
(2)制备操作中,加入的少量的水,其目的是
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)该实验装置中
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等:检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用如图2实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL 6mol/L NaOH溶液和2mL溴乙烷,振荡.
Ⅱ:将试管如图2固定后,水浴加热.
(6)观察到
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是
从海水得到的粗盐含有少量的CaCl2、MgSO4等杂质,某同学用粗盐进行提纯,获取纯净的食盐,实验步骤如图所示.请回答:

(1)步骤①和②的操作名称是
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
查看习题详情和答案>>

(1)步骤①和②的操作名称是
过滤
过滤
.(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止
溶液受热不均,造成液体飞溅
溶液受热不均,造成液体飞溅
,当蒸发皿中有较多量固体出现时,应移去酒精灯,用余热将溶液蒸干
移去酒精灯,用余热将溶液蒸干
.(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | 澄清石灰水变浑浊 澄清石灰水变浑浊 |
猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解, 加入盐酸, 加入盐酸, 然后向溶液中滴加BaCl2溶液 然后向溶液中滴加BaCl2溶液 |
产生白色沉淀 产生白色沉淀 |
猜想Ⅱ成立 |