网址:http://m.1010jiajiao.com/timu3_id_43289[举报]
(1)B核外电子排布式:
(2)E原子的最外层电子排布图:
(3)写出A、C直接形成的化合物与E的单质反应的离子方程式:
(4)写出B与D形成的化合物和水发生反应的化学方程式:
请回答;
(1)B核外电子排布式为
(2)写出A、C直接形成的化合物与E的单质反应的离子方程式
(3)写出B和D形成的化合物遇水时发生反应的化学方程式
(4)写出D的电子轨道排布式


(1)甲、乙两分子中含有非极性共价键的物质的电子式是
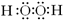
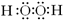
(2)C和D的离子中,半径较小的是
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
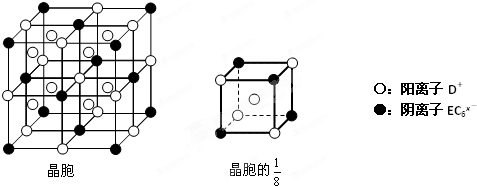
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是_________(填“A”或“D”);A离子和B离子中,半径较小的是_________(填离子符号)。
(2)元素C在元素周期表中的位置是__________________。
(3)写出C的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应的离子方程式__________________、__________________。
(4)下图表示由上述五种元素中的两种元素所形成的离子化合物的晶胞(晶胞是在晶体中具有代表性的最小重复单元)。阳离子(用“●”表示)位于该正方体的顶点和面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的化学式可能是_________、_________。

A、B、C、D、E为五种短周期元素,且原子序数依次增大。其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数。C原子的最外层中有两个不成对的电子。D、E的原子核内各自的质子数与中子数相等。C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素)。已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1。请回答下列问题:
(1)基态D原子的电子排布式为 ,单质B2中 键与
键与 键的数目之比为
键的数目之比为
(2)化合物BH3(H代表氢元素)的立体构型为____,B原子的杂化轨道类型 是 。
(3)C和E的最简单氢化物分别为甲和乙,请比较相同条件下甲、乙的沸点大小,并说明理 。
(4)A可以形成多种结构不同的单质,其中M是所有已知晶体中硬度最大的,其晶体类型是 ;若该晶体晶胞(如图所示)的边长为a cm,则其密度是 g·cm -3(只要求列式,不必计算出数值,阿伏加德罗常数为NA)。

查看习题详情和答案>>