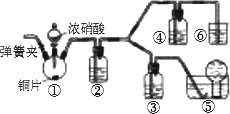
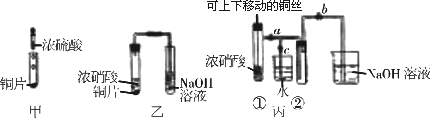
0 92419 92427 92433 92437 92443 92445 92449 92455 92457 92463 92469 92473 92475 92479 92485 92487 92493 92497 92499 92503 92505 92509 92511 92513 92514 92515 92517 92518 92519 92521 92523 92527 92529 92533 92535 92539 92545 92547 92553 92557 92559 92563 92569 92575 92577 92583 92587 92589 92595 92599 92605 92613 203614