|
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量下列叙述正确的是 | |
| [ ] | |
A. |
氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g) |
B. |
氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=183 kJ·mol-1 |
C. |
氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
D. |
氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
|
下列说法不正确的是 | |
| [ ] | |
A. |
任何化学反应都伴随有能量变化 |
B. |
化学反应中的能量变化都表现为热量的变化 |
C. |
反应物的总能量高于生成物的总能量时,发生放热反应 |
D. |
反应物的总能量低于生成物的总能量时,发生吸热反应 |
|
一定温度下,反应2SO2+O2 | |
| [ ] | |
A. |
0.4 mol |
B. |
0.6 mol |
C. |
0.8 mol |
D. |
1.2 mol |
|
能说明反应CO(g)+H2O(g) | |
| [ ] | |
A. |
容器内CO、H2O、CO2、H2四者共存 |
B. |
总的质量保持不变 |
C. |
总的物质的量保持不变 |
D. |
正反应速率和逆反应速率相等 |
|
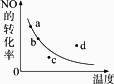
下图中的曲线是表示其他条件一定时,2NO+O2
| |
| [ ] | |
A. |
a点 |
B. |
b点 |
C. |
c点 |
D. |
d点 |
|
对可逆反应4NH3(g)+5O24 | |
| [ ] | |
A. |
达到化学平衡时,4v正(O2)=5v逆(NO) |
B. |
若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
C. |
达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
D. |
化学反应速率关系是:2v正(NH3)=3v正(H2O) |
|
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) | |
| [ ] | |
A. |
HI的生成速率等于其分解速率 |
B. |
HI的生成速率小于其分解速率 |
C. |
HI的生成速率大于其分解速率 |
D. |
无法判断HI的生成速率和分解速率的相对大小 |
|
一定条件下,在密闭容器中投入1 mol N2与3 mol H2,进行如下可逆反应: N2+3H2 下列关于该可逆反应建立平衡过程的描述中,错误的是 | |
| [ ] | |
A. |
平衡前,N2、H2的物质的量浓度越来越小 |
B. |
平衡前,NH3的分解速率越来越大 |
C. |
平衡前,混合气体的平均相对分子质量越来越大 |
D. |
平衡时生成了2 mol NH3 |
|
NO和CO都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2CO(g)+2NO(g) | |
| [ ] | |
A. |
使用催化剂只能加快正反应速率 |
B. |
降低压强能加快逆反应速率 |
C. |
改变压强对反应速率无影响 |
D. |
升高温度能加大反应速率 |