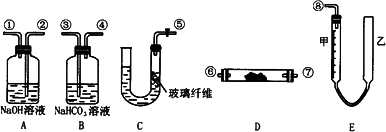
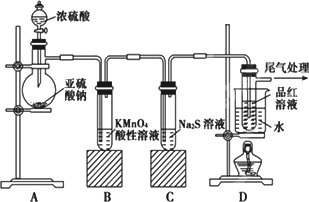
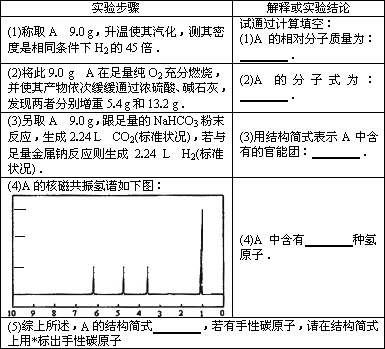
0 88172 88180 88186 88190 88196 88198 88202 88208 88210 88216 88222 88226 88228 88232 88238 88240 88246 88250 88252 88256 88258 88262 88264 88266 88267 88268 88270 88271 88272 88274 88276 88280 88282 88286 88288 88292 88298 88300 88306 88310 88312 88316 88322 88328 88330 88336 88340 88342 88348 88352 88358 88366 203614