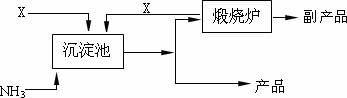
0 87462 87470 87476 87480 87486 87488 87492 87498 87500 87506 87512 87516 87518 87522 87528 87530 87536 87540 87542 87546 87548 87552 87554 87556 87557 87558 87560 87561 87562 87564 87566 87570 87572 87576 87578 87582 87588 87590 87596 87600 87602 87606 87612 87618 87620 87626 87630 87632 87638 87642 87648 87656 203614



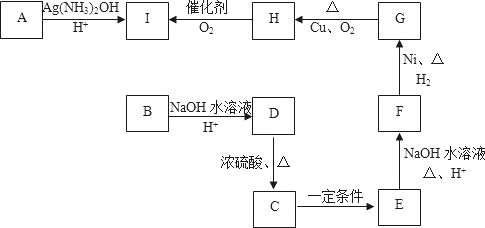

 ),反应的化学方程式是:
),反应的化学方程式是:
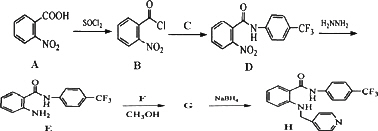
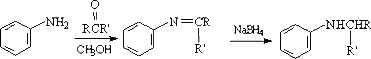
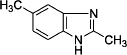 是一种抗癌、消炎药物.利用题给相关信息,以
是一种抗癌、消炎药物.利用题给相关信息,以