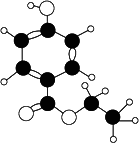
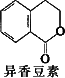
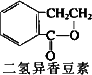
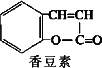
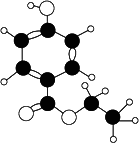
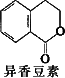
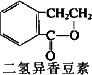
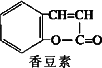
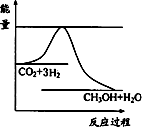
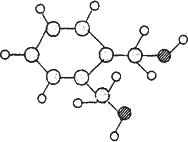
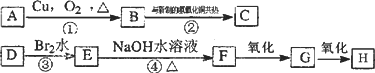
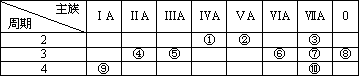
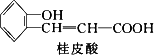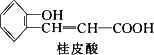0 87453 87461 87467 87471 87477 87479 87483 87489 87491 87497 87503 87507 87509 87513 87519 87521 87527 87531 87533 87537 87539 87543 87545 87547 87548 87549 87551 87552 87553 87555 87557 87561 87563 87567 87569 87573 87579 87581 87587 87591 87593 87597 87603 87609 87611 87617 87621 87623 87629 87633 87639 87647 203614