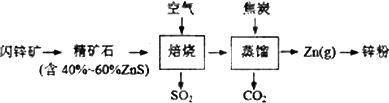
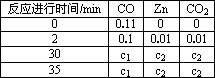
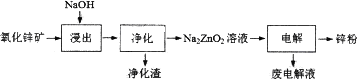0 87439 87447 87453 87457 87463 87465 87469 87475 87477 87483 87489 87493 87495 87499 87505 87507 87513 87517 87519 87523 87525 87529 87531 87533 87534 87535 87537 87538 87539 87541 87543 87547 87549 87553 87555 87559 87565 87567 87573 87577 87579 87583 87589 87595 87597 87603 87607 87609 87615 87619 87625 87633 203614









 H2+2NiOOH
H2+2NiOOH