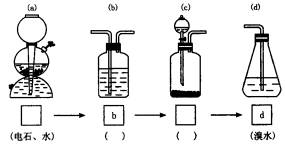
(重组提高)为了除去工业废气中的SO2,查得一个“将SO2转化为(NH4)2SO4”的资料,该资料中有以下内容:“初步处理后的废气含0.2%(体积分数,下同)的SO2和10%的O2,在673K,废气以每小时5m3的速度通过V2O5,催化层与NH3(20dm3·h-1)混合,再喷入水(290g·h-1),此时气体温度迅速由673K下降到473K,在热的结晶装置中得到硫酸铵晶体。”
0 87314 87322 87328 87332 87338 87340 87344 87350 87352 87358 87364 87368 87370 87374 87380 87382 87388 87392 87394 87398 87400 87404 87406 87408 87409 87410 87412 87413 87414 87416 87418 87422 87424 87428 87430 87434 87440 87442 87448 87452 87454 87458 87464 87470 87472 87478 87482 87484 87490 87494 87500 87508 203614
(1)阅读上文后,请回答下列问题:
①按反应式2SO2+O2=2SO3,SO2与O2的物质的量之比为2∶1,资料中为什么用1%∶50%?
②计算通人废气中的SO2与通人的NH3的物质的量之比
③如果某厂每天排放10000m3这种废气,按上述方法把SO2回收为(NH4)2SO4。估计每月(30天)需多少立方米氨?可得多少吨( (10分)某化学反应的方程式如下:KMnO4+KI+H2SO4=MnSO4+I2+KIO3+
K2SO4
(1)该反应的氧化剂是________
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的计量系数是
②在下面的化学式上标出电子转移的方向和数目:KMnO4+KI+H2SO4。
(3)如果没有对该方程式中的某些计量系数作限定,可能的配平系数有许多组,原因是
________