工业上制备氯化铜时,是将浓盐酸有蒸气加热80℃左右,慢慢加入粗制的CuO粉末(含有杂质FeO),用浓盐酸溶解,得到的氯化铜溶液中含有一定量的Fe2+。
|
金属离子 |
pH |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
⑴从上表提供的数据看,不能直接将溶液的PH调到9.6除去Fe2+,其原因是 。
⑵实际生产中使用次氯酸钠的目的是 ,加入次氯酸钠后,溶液的pH
(选填“增大”“减小”“不变”),然后用试剂将溶液PH调至适当范围,即可除去铁杂质。⑶调节溶液pH宜选用的试剂是 (写序号)。
A. Ba(OH)2 B. NgCO3
C. CuO D. 稀HCl
如图为向盛有0.2 mol•L-1 50 mL明矾溶液中,慢慢加入0.1 mol•L-1 Ba(OH)2溶液,生成沉淀的质量随着加入Ba(OH)2溶液的体积变化的图像,当产生的沉淀量最大时(即B点)改加0.5 mol•L-1 HCl.沉淀总质量又发生变化(虚线部分)。

⑴写出OA、AB、C、CD四段发生反应的化学方程式。
⑵计算A、B、C、D点所加入Ba(OH)2溶液、盐酸体积及沉淀质量并填入下表。
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(沉淀)/g |
|
|
工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如下:
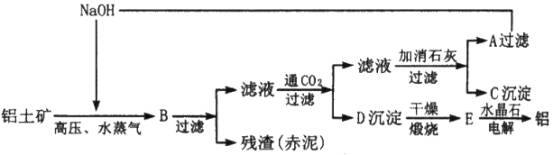
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分见下表(以氧化物表示,Na2O由NaOH折算),且已知铝土矿中的Fe2O3全部转入赤泥。
|
|
Al2O3 |
Fe2O3 |
Na2O |
|
铝土矿 |
55% |
16% |
0% |
|
赤泥 |
15% |
48% |
8% |
⑴生产中每消耗1 t铝土矿将产生 t赤泥
⑵试计算每炼出1 t铝,理论上需要多少吨铝土矿?应补充多少吨NaOH?