��Ŀ����
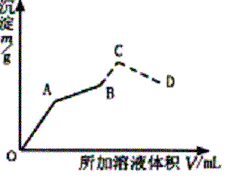
��ͼΪ��ʢ��0.2 mol•L-1 50 mL������Һ�У���������0.1 mol•L-1 Ba(OH)2��Һ�����ɳ������������ż���Ba(OH)2��Һ������仯��ͼ�������ij��������ʱ����B�㣩�ļ�0.5 mol•L-1 HCl.�����������ַ����仯�����߲��֣���

��д��OA��AB��C��CD�Ķη�����Ӧ�Ļ�ѧ����ʽ��
�Ƽ���A��B��C��D��������Ba(OH)2��Һ��������������������������±���
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(����)/g |
|
|
������
��OA�η�ӦΪ��2KAl(SO4)2+3Ba(OH)2=3BaSO4��+2Al(OH)3��+K2SO4 AB�η�ӦΪ��KAl(SO4)2+ 2Ba(OH)2==KAlO2+2BaSO4��+2H2O BC�η�ӦΪ��KAlO2+HCl+H2O=Al(OH)3��+KCl CD�η�ӦΪ��Al(OH)3+3HCl=AlCl3+3H2O ��A��ʱ���� 2KAl(SO4)2 �� 3Ba(OH)2 �� 3BaSO4 �� 2 Al(OH)3 2������������ 3�������� 3 �������� 2 0.2��0.05����
VA��0.1���� ��VA = �ó���mA= B��ʱ�У� KAl(SO4)2 �� 2Ba(OH)2 �� 2BaSO4 1������������ 2���� �������� 2 0.2��0.05�������� 0.1VB�������� 2��0.2��0.05 VB=0.2 L�� ��200 mL Ba(OH)2��Һ mB=0.1��0.2��233=4.66g
|