|
下列溶液中微粒的物质的量浓度关系正确的是 | |
A. |
室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(SO42-)>c(Na+)>c(NH4+)>c(OH-)=c(H+) |
B. |
若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-) |
C. |
0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
D. |
物质的量都是0.1 mol的HCN和NaCN混合后配成1 L溶液,c(HCN)+c(CN-)=0.1 mol·L-1 |
|
下列各组离子,在指定环境中一定能大量共存的是 | |
A. |
在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl- |
B. |
在pH为7的溶液中:Ag+、Mg2+、SO42-、Cl- |
C. |
在澄清透明的无色溶液中:Al3+、Cu2+、HCO3- 、NO3- |
D. |
c(OH-)=1×10-3 mol/L的溶液中:K+、SO42-、Cl-、CO32- |
|
25℃时,水的电离达到平衡:H2O | |
A. |
向平衡体系中加入水,平衡正向移动,c(OH-)增大 |
B. |
将水加热,Kw增大,pH不变 |
C. |
向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
D. |
向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 |
|
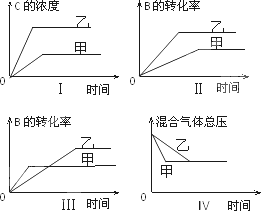
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
下列判断一定错误的是 | |
A. |
图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
B. |
图Ⅱ研究的是压强对反应的影响,且乙的压强较高 |
C. |
图Ⅲ研究的是温度对反应的影响,且甲的温度较高 |
D. |
图Ⅳ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
|
下列反应方程式中正确的是 | |
A. |
碳酸钠的水解方程式:2H2O+CO32- |
B. |
用盐酸溶解碳酸钙的离子方程式:2H++CaCO3 |
C. |
甲醇的燃烧热的热化学方程式:CH3OH(l)+ |
D. |
CaCO3的电离方程式:CaCO3 |
|
已知离子氧化性Fe3+>Cu2+>Fe2+>Zn2+在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉,下列说法中不正确的是 | |
A. |
若锌粉有剩余,则不溶物中一定有铜,可能有铁 |
B. |
若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ |
C. |
若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ |
D. |
若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
|
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol·L-1为 | |
A. |
(y-2x)/a |
B. |
(y-x)/a |
C. |
(2y-2x)/a |
D. |
(2y-4x)/a |
|
下列物质发生反应时其离子方程式正确的是 | |
A. |
铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+ |
B. |
氯化铝溶液中加入过量的氨水Al3++4NH3·H2O |
C. |
Fe(OH)3跟盐酸反应:Fe(OH)3+3H+ |
D. |
钠和冷水反应:Na+2H2O |
|
下列各组离子一定能大量共存的是 | |
A. |
含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- |
B. |
在强碱性溶液中:Na+、K+、AlO2-、CO32- |
C. |
在能与铝置换出氢气的溶液中:NH4+、Al3+、SO42-、NO3- |
D. |
常温时,在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
|
设NA表示阿伏加德罗常数的数值,下列说法正确的是 | |
A. |
标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为2NA |
B. |
7 g CnH2n中含有的氢原子数目为NA |
C. |
任何气体单质在标况下体积若为22.4 L,则含有2NA个原子 |
D. |
1 mol Na2O2与水反应转移的电子数约为1.204×1024个 |