|
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO | |
A. |
高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 |
B. |
反应的氧化产物只有氧气 |
C. |
当反应产生标准状况下2.24 L O2时,反应转移的电子为0.2 mol |
D. |
向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液 |
|
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O | |
A. |
2Na2O2+2H2O=4NaOH+O2↑ |
B. |
4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
C. |
2F2+2H2O=4HF+O2 |
D. |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
|
下列离子方程式正确的是 | |
A. |
用 Na2O2和H2O反应制备O2:Na2O2+H2O |
B. |
用氢氧化钠溶液除去金属铝表面的氧化膜 :Al2O3+2OH- |
C. |
用食醋除去水瓶中的水垢 :2CH3COOH+CO |
D. |
等体积、等浓度的 Ba(OH)2浓溶液和NH4HCO3浓溶液混合后并加热,有气体和沉淀产生:Ba2++2OH-+NH |
|
在下列给定条件的溶液中 ,可能大量共存的离子组是 | |
A. |
无色溶液:Cu2+、、H+、Cl-、NO |
B. |
能使酚酞试液呈红色的溶液:Na+、K+、Cl-、CO |
C. |
能与金属Al反应放出H2的溶液中:Na+、Cl-、SO |
D. |
含有HCO |
|
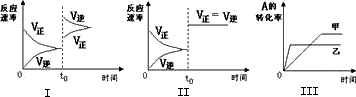
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g)
| |
A. |
图Ⅰ可体现t0时升高温度对反应速率的影响 |
B. |
图 Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
C. |
图 Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
D. |
图 Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
|
已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法错误的是 | |
A. |
电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 |
B. |
H2(g)+F2(g)=2HF(g) ΔH=-270 kJ/mol,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
C. |
相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2是一个吸热反应 |
D. |
破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3 |
|
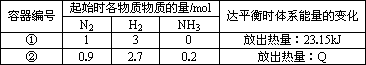
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 下列叙述错误的是 | |
A. |
容器①、②中反应的平衡常数相等 |
B. |
平衡时,两个容器中NH3的体积分数均为1/7 |
C. |
容器②中达平衡时放出的热量Q=23.15 kJ |
D. |
若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ |
|
已知:NaA水溶液呈碱性,常温下将0.10 mol NaA和0.05 mol HCl溶于水,得到PH<7的溶液,则溶液中离子浓度关系正确的是 | |
A. |
c(A-)+c(OH-)=c(Na+)+c(H+) |
B. |
c(Na+)>c(A-)>c(H+)>c(OH-) |
C. |
c(HA)+c(A-)=2c(Na+) |
D. |
c(Na+)>c(Cl-)>c(A-)>c(H+) |
|
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是 | |
A. |
明矾水解的离子方程式:Al3++3H2O |
B. |
CaCO3(s)=CaO( s)+CO2(g) ΔS>0 |
C. |
用纯碱溶液洗涤餐具的原因,用离子方程式表示:CO32-+2H2O |
D. |
BaSO4悬浊液中存在平衡:BaSO4(s) |
|
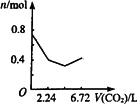
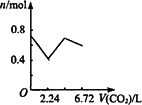
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解和水的电离) | |
A. |
|
B. |
|
C. |
|
D. |
|