|
两种气态烃以任意比例混合,在 105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10 L.下列各组混合烃中不符合此条件的是 | |
A. |
CH4、C2H4 |
B. |
CH4、C3H6 |
C. |
C2H4、C3H4 |
D. |
C2H2、C3H6 |
|
0.1 mol由两种气态烃组成的混合气体完全燃烧后,得到0.16 mol的二氧化碳和3.6 g水,下列对混合气体的说法正确的是 | |
A. |
一定有甲烷 |
B. |
一定是甲烷和乙烯 |
C. |
一定没有乙烷 |
D. |
一定有丙炔 (C3H4) |
|
一定量的甲烷燃料后得到的产物 CO、CO2和水蒸气,其总质量为49.6 g,当其缓慢经过无水CaCl2时,CaCl2增重25.2 g,原混合气体中CO2的质量是 | |
A. |
12.5 g |
B. |
13.2 g |
C. |
19.7 g |
D. |
24.4 g |
|
浓盐酸和次氯酸钙能发生如下反应: Ca(ClO)2+4HCl(浓) 用贮存很久的漂白粉(漂白粉是Cl2通入石灰乳中制得的)与浓盐酸制得的氯气中,可能含有的杂质气体是 ①CO2 ②HCl ③H2O ④O2 | |
A. |
①②③ |
B. |
②③④ |
C. |
②③ |
D. |
①④ |
|
有a、b、c、d四种金属,将a与b用导线连接起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是 | |
A. |
d、c、a、b |
B. |
d、a、b、c |
C. |
d、b、a、c |
D. |
b、a、d、c |
|
有 X、Y、Z、W四种金属,已知X(OH)3的碱性大于Y(OH)3的碱性,X3+可使Z氧化,W可与热水反应产生H2,X不能与热水反应,把X的金属片插入稀硫酸中,让金属丝Z与X接触,则X的溶解速率加快.这四种金属活动性强弱的关系一定是 | |
A. |
X>Y |
B. |
Z>Y |
C. |
W>Z |
D. |
Z>X |
|
850℃条件下,存在如下平衡: CO2(g)+H2(g) 平衡时有90%(体积分数)的氢气转化为水,且知在平衡状态下存在如下关系: c(CO2)·c(H2)=c(CO)·c(H2O) 则原混合气体中二氧化碳和氢气的体积之比为 | |
A. |
1∶1 |
B. |
5∶1 |
C. |
9∶1 |
D. |
10∶1 |
|
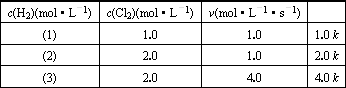
反应速率v和反应物浓度的关系是用实验方法测定的.化学反应:H2(g)+Cl2(g)
由此可推得m、n值正确的是 | |
A. |
m =1,n=1 |
B. |
m = |
C. |
m = |
D. |
m =1,n= |
|
某课外兴趣小组进行如下实验,在a瓶中放入10 g黄豆粒大小的石灰石,在b瓶中放入5 g粉末状石灰石,然后分别加入50.0 mL 1.0 mol·L-1的盐酸.图中横轴代表时间,纵轴代表瓶中碳酸钙减少的质量,其中能正确表示实验结果的是 | |
A. |
|
B. |
|
C. |
|
D. |
|
|
已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气.下列叙述正确的是 | |
A. |
LiH的水溶液显中性 |
B. |
LiH中的氢离子可以被还原成氢气 |
C. |
LiH是一种强氧化剂 |
D. |
LiH中氢离子比锂离子的离子半径大 |