某学生拟用含有FeSO4和 Fe2(SO4) 3的CuSO4溶液提纯CuSO4,并测定铜的相对原子质量,其实验流程如图1所示:
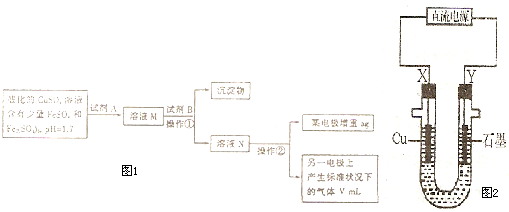
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 供选择的试剂有:Cl2、H2O2、浓H2SO4、NOH、CuO、Cu | ||
(1)试剂A的化学式为______,加入试剂A反应的离子方程式为______,试剂B的化学式为______,加入 B 的作用是______,操作①的名称是______.
(2)操作②中所用仪器装置如图2所示:则 X 应接直流电源的______极,Y电极上发生的电极反应式为:______.
(3)下列实验操作必要的是______(填字母).
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极的烘干称重的操作中必须按:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)向电解后的溶液中加入石态溶液,观察到的现象是______.
(5)铜的相对原子质量的计算式为______.
下列离子方程式表达不正确的是
- A.用惰性电极电解氯化钠溶液:

- B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-+3H2O═

- C.用水吸收二氧化氮:3NO2+H2O═

- D.水玻璃中通入足量的CO2:
 ═
═
 某学习小组为测定市售过氧化钠纯度,设计了如下方案:
某学习小组为测定市售过氧化钠纯度,设计了如下方案: 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,完成下列问题: (x+y)mol
(x+y)mol
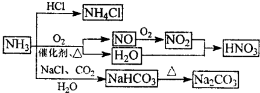 NH3是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法正确的是
NH3是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法正确的是