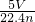题目内容
四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
在四支试管中分别取四种溶液各1mL,做下列实验.
(1)在四支试管中分别滴入______(填试剂名称),检验出的物质是______,发生反应的化学方程式是______;
(2)在剩余三支试管中分别滴入______(填试剂的化学式),检验出的物质是______,发生反应的离子方程式是______;
(3)在剩余两支试管中分别滴入______(填试剂的化学式),检验出的物质是______.
解:(1)硝酸只能和碳酸钠反应生成二氧化碳气体,原理是:CO32-+2H+=CO2↑+H2O,可以先在四支试管中分别滴入稀HNO3,鉴别出碳酸钠,
故答案为:HNO3;Na2CO3;Na2CO3+2HNO3═2NaNO3+H2O+CO2↑;
(2)NaNO3溶液、Na2SO4溶液和NaCl溶液中,只有Na2SO4溶液和硝酸钡发生复分解反应生成白色沉淀,所以可以再在剩余三支试管中分别滴入硝酸钡,鉴别硫酸钠,
离子方程式是SO42-+Ba2+═BaSO4↓,故答案为:Ba(NO3)2;Na2SO4;SO42-+Ba2+═BaSO4↓;
(3)硝酸铵和氯化钠的鉴别可以采用硝酸银来进行,氯化钠可以和硝酸银反应生成氯化银白色沉淀,故答案为:AgNO3;NaCl.
分析:(1)强酸可以和碳酸钠反应生成二氧化碳气体;
(2)硫酸钠和硝酸钡发生复分解反应生成硫酸钡沉淀和硝酸钠;
(3)硝酸银和氯化钠反应生成氯化银和硝酸钠.
点评:本题考查学生离子方程式书写的知识,是现在高考的热点,难度不大.
故答案为:HNO3;Na2CO3;Na2CO3+2HNO3═2NaNO3+H2O+CO2↑;
(2)NaNO3溶液、Na2SO4溶液和NaCl溶液中,只有Na2SO4溶液和硝酸钡发生复分解反应生成白色沉淀,所以可以再在剩余三支试管中分别滴入硝酸钡,鉴别硫酸钠,
离子方程式是SO42-+Ba2+═BaSO4↓,故答案为:Ba(NO3)2;Na2SO4;SO42-+Ba2+═BaSO4↓;
(3)硝酸铵和氯化钠的鉴别可以采用硝酸银来进行,氯化钠可以和硝酸银反应生成氯化银白色沉淀,故答案为:AgNO3;NaCl.
分析:(1)强酸可以和碳酸钠反应生成二氧化碳气体;
(2)硫酸钠和硝酸钡发生复分解反应生成硫酸钡沉淀和硝酸钠;
(3)硝酸银和氯化钠反应生成氯化银和硝酸钠.
点评:本题考查学生离子方程式书写的知识,是现在高考的热点,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
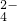 、CO
、CO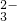 、Cl-.
、Cl-.