氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(如表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
工业CuSO4
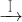
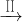 CuSO4溶液
CuSO4溶液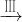 CuSO4?5H2O…CuO
CuSO4?5H2O…CuO(1)步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是______.
(2)步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①这一步骤的目的是______,
②写出加入H2O2溶液时发生反应的离子方程式______
③控制溶液pH=3.5的目的是______,
(3)步骤Ⅲ的目的是得到CuSO4?5H2O晶体,操作是______,水浴加热烘干所得固体.水浴加热的特点是______.
㈡探究氧化铜性质
(1)取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是______.
(2)为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为______.(填写序号)
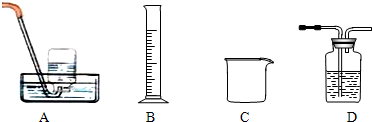
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥NH3 |
| B | SO2有漂白性 | SO2可使溴水的橙色褪去 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
- A.A
- B.B
- C.C
- D.D

 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=______mol?L-1?min-1.若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于______之间.
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=______mol?L-1?min-1.若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于______之间.