下列离子检验方法和结论相符的一组是
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入BaCl2溶液,有白色沉淀生成 | 未知溶液中一定含有SO42- |
| B | 向一种未知溶液中滴加KSCN溶液,溶液变为红色 | 未知溶液中不含Fe2+ |
| C | 向一种未知溶液中加入盐酸酸化,然后再滴加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 不能确定未知溶液中一定含有CO32- |
- A.A
- B.B
- C.C
- D.D
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是______.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为______.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
| ______ | ______ |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:______.
实验3:进行实验以确定可能的原因.
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因:______.
 如图是化学实验室某试剂瓶标签上的部分内容.下列相关叙述错误的是
如图是化学实验室某试剂瓶标签上的部分内容.下列相关叙述错误的是 +______,
+______,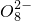 +H2O→Mn
+H2O→Mn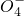 +S
+S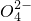 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol. 有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去.
有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去.