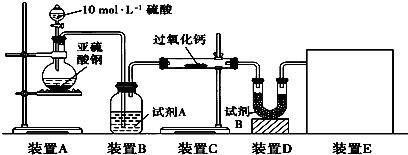
有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.某同学进行如下验证和对比实验.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验I | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生; 一段时间后,溶液逐渐变黑; 试管壁附着有银镜 |
| 实验II | 2mL银氨溶液和数滴浓氨水 | 有气泡产生; 一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3+H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是______.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3,产生的现象是______.
②产生Ag2O的原因是______.
(3)该同学对产生银镜的原因提出瑕设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入______,出现黑色沉淀;水浴加热,未出现银镜.
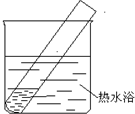
(4)重新假设:在NaOH存在下,可能是NH3还原Ag2O.用图1所示装置进行实验.现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是______.
②实验结果证实假设成立,依据的现象是______.
(6)用HNO3清洗试管壁上的Ag,该反应的化学方程式是______.
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______简述你的理由(不需写出反应的方程式 )______.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是______,写出发生反应的离子方程式______.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为______.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
①试剂I为______,试剂II为______(填字母).
②固体X的化学式为______.
③操作I为______.
蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如图所示.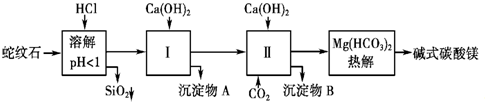
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是______.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______(填入物质的化学式),然后______(依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是______(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③______.
④______.
⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=______,b=______,c=______.
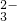 +H2O═HCO
+H2O═HCO +OH-
+OH-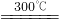 2HNO3+4N2↑+9H2O中,每生成4mol N2,转移电子数为15NA
2HNO3+4N2↑+9H2O中,每生成4mol N2,转移电子数为15NA