随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺.
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式______.
(2)反应①的离子方程式是______.
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为______.
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为______.
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为______,为保证产品纯度,还应进行的操作名称是______.
有一种白色粉末,可能含有下列阴离子和阳离子中的几种,阴离子:S2-、Cl-、NO 、SO
、SO 、CO
、CO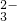 、HCO
、HCO 、MnO
、MnO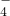 .阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH
.阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH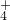 .现将该白色粉末进行下列实验:
.现将该白色粉末进行下列实验:
| 实验操作 | 现象 |
| a、取少量粉末,加水、振荡 | 全部溶解、溶液无色透明 |
| b、向所得溶液中慢慢滴入NaOH溶液并加热 | 无明显现象 |
| 实验操作 | 现象 |
| c、取少量粉末,加盐酸 | 无明显现象 |
| b、取少量粉末,加稀BaCl2和稀盐酸的混合液 | 有白色沉淀生成 |
(1)从a实验中,可推断粉末中不可能有______;
(2)从b实验中,可推断粉末中不可能有______;
(3)从c实验中,可推断粉末中不可能有______;
(4)从d实验中,可推断粉末中不可能有______,必定含有______;
(5)综上所述,粉末中还可能含有______.
类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁反应,当Cl2过量时生成FeCl3,当铁粉过量时产物是FeCl2.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
(1)提出假设:
假设1:该固体物质是FeCl2;
假设2:该固体物质是______;
假设3:该固体物质是______.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解,然后取两份A溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | ______. | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |



