题目内容
有一种白色粉末,可能含有下列阴离子和阳离子中的几种,阴离子:S2-、Cl-、NO 、SO
、SO 、CO
、CO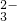 、HCO
、HCO 、MnO
、MnO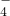 .阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH
.阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH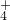 .现将该白色粉末进行下列实验:
.现将该白色粉末进行下列实验:
| 实验操作 | 现象 |
| a、取少量粉末,加水、振荡 | 全部溶解、溶液无色透明 |
| b、向所得溶液中慢慢滴入NaOH溶液并加热 | 无明显现象 |
| 实验操作 | 现象 |
| c、取少量粉末,加盐酸 | 无明显现象 |
| b、取少量粉末,加稀BaCl2和稀盐酸的混合液 | 有白色沉淀生成 |
(1)从a实验中,可推断粉末中不可能有______;
(2)从b实验中,可推断粉末中不可能有______;
(3)从c实验中,可推断粉末中不可能有______;
(4)从d实验中,可推断粉末中不可能有______,必定含有______;
(5)综上所述,粉末中还可能含有______.
解:(1)取少量粉末,加水、振荡,全部溶解、溶液无色透明,则一定不含有MnO4-、Fe2+、Fe3+、Cu2+等有颜色的离子,故答案为:MnO4-、Fe2+、Fe3+、Cu2+;
(2)向所得溶液中慢慢滴入NaOH溶液并加热无明显现象,说明不含NH4+、Mg2+、Al3+,
故答案为NH4+、Mg2+、Al3+:
(3)取少量粉末,加盐酸无明显现象,说明不含S2-、CO32-、HCO3-,故答案为:S2-、CO32-、HCO3-;
(4)取少量粉末,加稀BaCl2和稀盐酸的混合液,有白色沉淀生成,说明含有SO42-,一定不含有Ba2+,
故答案为:SO42-;Ba2+;
(5)题中Na+、Cl-、NO3-与以上物质都不反应,则可能含有Na+、Cl-、NO3-,故答案为:Na+、Cl-、NO3-.
分析:a、取少量粉末,加水、振荡,全部溶解、溶液无色透明,则一定不含有MnO4-、Fe2+、Fe3+、Cu2+等有颜色的离子;
b、向所得溶液中慢慢滴入NaOH溶液并加热无明显现象,说明不含NH4+、Mg2+、Al3+;
c、取少量粉末,加盐酸无明显现象,说明不含S2-、CO32-、HCO3-;
b、取少量粉末,加稀BaCl2和稀盐酸的混合液,有白色沉淀生成,说明含有SO42-,一定不含有Ba2+,以此解答该题.
点评:本题考查常见离子的检验,难度中等,本题注意通实验现象判断,把握物质的典型性质,作为推断的突破口.
(2)向所得溶液中慢慢滴入NaOH溶液并加热无明显现象,说明不含NH4+、Mg2+、Al3+,
故答案为NH4+、Mg2+、Al3+:
(3)取少量粉末,加盐酸无明显现象,说明不含S2-、CO32-、HCO3-,故答案为:S2-、CO32-、HCO3-;
(4)取少量粉末,加稀BaCl2和稀盐酸的混合液,有白色沉淀生成,说明含有SO42-,一定不含有Ba2+,
故答案为:SO42-;Ba2+;
(5)题中Na+、Cl-、NO3-与以上物质都不反应,则可能含有Na+、Cl-、NO3-,故答案为:Na+、Cl-、NO3-.
分析:a、取少量粉末,加水、振荡,全部溶解、溶液无色透明,则一定不含有MnO4-、Fe2+、Fe3+、Cu2+等有颜色的离子;
b、向所得溶液中慢慢滴入NaOH溶液并加热无明显现象,说明不含NH4+、Mg2+、Al3+;
c、取少量粉末,加盐酸无明显现象,说明不含S2-、CO32-、HCO3-;
b、取少量粉末,加稀BaCl2和稀盐酸的混合液,有白色沉淀生成,说明含有SO42-,一定不含有Ba2+,以此解答该题.
点评:本题考查常见离子的检验,难度中等,本题注意通实验现象判断,把握物质的典型性质,作为推断的突破口.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
 中的一种或几种.进行如下几步实验:
中的一种或几种.进行如下几步实验: 、NaCl、
、NaCl、 、
、 、
、 中的一种或几种.进行如下几步实验:
中的一种或几种.进行如下几步实验: 、NaCl、
、NaCl、 、
、 、
、 的一种或几种.进行如下几步实验:
的一种或几种.进行如下几步实验: