在实验室中,为验证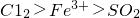 的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
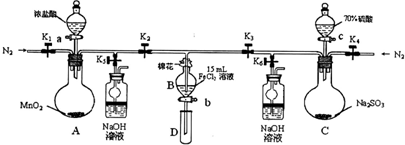
(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是______.
(2)关闭K1、K3、K4,打开活塞a,滴加一定量的浓盐酸,给A加热,A中发生反应的离子方程式为______.
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,这样做的原因是______.
(4)打开活塞b,使约2mL的溶液流入试管D中,滴入______可以证明其中是否含有Fe3+离子.
(5)打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3并打开K6,用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______.
(6)更新试管D,打开活塞b,使约2mL的溶液流入试管D中,检验B溶液中的离子.检验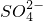 所需的试剂是______.
所需的试剂是______.
A.Ba(NO3)2溶液 B.BaC12溶液 C.AgNO3溶液 D.Ba(OH)2溶液
甲、乙、丙三位同学分别对两次B中得到的溶液进行了有关离子的检测,他们的检测结果一定能够证明氧化性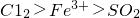 的是______.
的是______.
| 第一次B中溶液含有离子 | 第二次B中溶液含有离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO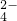 |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO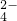 |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
CoCl2?6H2O是一种饲料营养强化剂.以含钴(Co)废料(含少量Fe、Al等杂质)制取CoCl2?6H2O的一种新工艺,流程如图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为______.
(2)加入碳酸钠调节pH至a,a的范围是______.
(3)操作I包含3个基本实验操作,它们是______和过滤.
(4)制得的CoCl2?6H2O需减压烘干的原因是______.
(5)为测定产品中CoCl2?6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2?6H2O的质量分数大于100%,其原因可能是______.
(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是______.
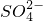 、Cl-、NO3-三种阴离子,则溶液中大量存在的阳离子是
、Cl-、NO3-三种阴离子,则溶液中大量存在的阳离子是



 mol/L
mol/L mol/L
mol/L mol/L
mol/L