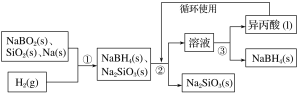
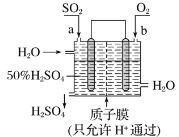
【题目】(1)250℃时,以镍合金为催化剂,向初始体积为 8L 的密闭容器中通入 5molCO2、3molCH4,在恒压条件下发生反应:CO2(g) +CH4(g)2CO(g) + 2H2(g)。平衡体系中甲烷的物质的量变化见表。
反应时间(s) | 2 | 4 | 6 | 8 |
CH4物质的量(mol) | 2.7 | 2.4 | 2.0 | 2.0 |
此温度下,该反应的平衡常数K =_____。
(2)二甲醚催化重整制氢的反应过程,主要有以下几个反应(数据为 25℃、1.01×105Pa 测定)
① CH3OCH3(g) + H2O(l)2CH3OH(l) △H=+24.52kJ/mol
② CH3OH(l) + H2O(l)CO2(g) + 3H2(g) △H=+49.01kJ/mol
③ CO(g) + H2O(l)CO2(g) + H2(g) △H=-41.17kJ/mol
④ CH3OH(l)CO (g) + 2H2(g) △H=+90. 18kJ/mol
则 CH3OCH3(g) +3H2O(l)2CO2(g) + 6H2(g) △H =_____kJ/mol
(3)上述(2)中二甲醚催化重整制氢的过程中测得不同温度下各组分体积分数及二甲醚的转化率关系如图所示:
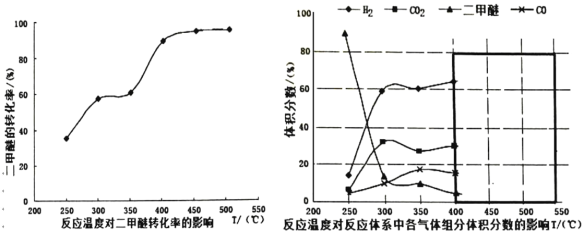
①你认为反应控制的最佳温度应为_____________,理由是__________。
A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
②在一个绝热恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据的是____________。
A.体系的温度不再改变 B.气体的平均相对分子质量保持不变
C.CO 的体积分数不变 D.气体的密度保持不变
③ 在温度达到 400℃以后,二甲醚与 CO2以几乎相同的变化趋势明显降低,而 CO 和 H2发体积分数也以几乎相同的变化趋势升高。则此时发生的反应为_______________试在图中黑色方框内画出 400℃以后的 CH3OCH3和 CO 体积分数的变化趋势____。