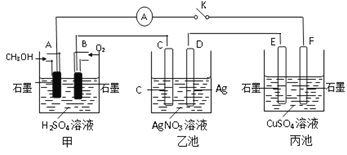
【题目】下表是几种常见弱酸的电离平衡常数(25℃ )
化学式 | H2CO3 | CH3COOH | HClO |
电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 3.0×10-8 |
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_____________________________________。
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+)B.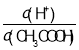 C.c(H+)c(OH﹣)D.
C.c(H+)c(OH﹣)D.![]() E.
E.![]()
(3)25℃时,等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH从小到大依次是_____________________________________。
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,溶液中离子浓度大小关系:_________________
(5)下列反应不能发生的是______(填字母)。
a.![]() +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.![]() +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=![]() +2HClO
+2HClO