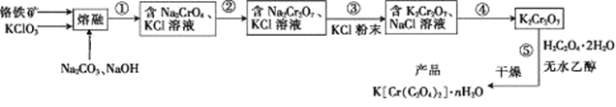
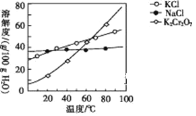
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
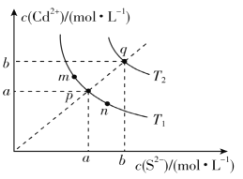
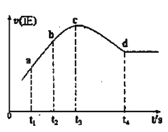
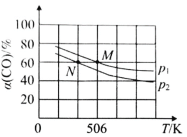
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
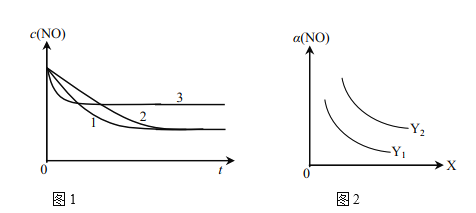
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
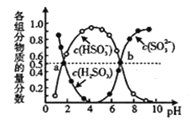
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
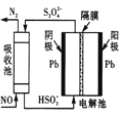
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为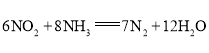 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。