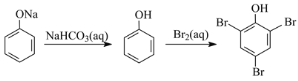
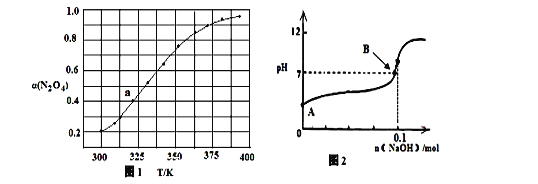
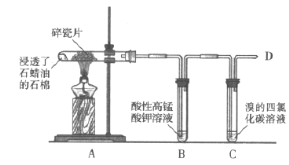
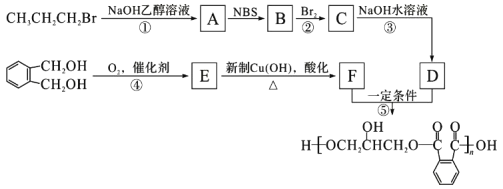
0 201357 201365 201371 201375 201381 201383 201387 201393 201395 201401 201407 201411 201413 201417 201423 201425 201431 201435 201437 201441 201443 201447 201449 201451 201452 201453 201455 201456 201457 201459 201461 201465 201467 201471 201473 201477 201483 201485 201491 201495 201497 201501 201507 201513 201515 201521 201525 201527 201533 201537 201543 201551 203614