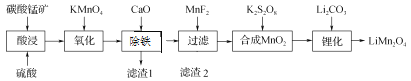
【题目】工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
已知:部分离子沉淀的pH值。
离子 | 开始沉淀的pH值 | 沉淀完全时的pH值 |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
(1) 为了提高碳酸锰矿浸岀的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_____等。
(2) 氧化时发生的离子方程式:_________。
(3) 加入CaO“除铁”的原理是____________。
(4) 加入MnF2为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1[常温时,Ksp(CaF2)=2.7×10-11]。
(5) “锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5 h,然后升温至600~750 ℃,保温24 h,自然冷却至室温得产品。升温到515 ℃时,开始有CO2产生,比预计碳酸锂的分解温度(723 ℃)低得多。可能的原因是________。
【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
【题目】一定温度下,向容积为2 L的密闭容器中充入一定量的气体A和气体B,发生反应: 2A(g)+B(g) ![]() 2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(A)/mol | n(B)/mol |
0 | 0.10 | 0.060 |
t1 | 0.012 | |
t2 | 0.016 |
A.在0~t1 min内的平均反应速率为v(C)=![]() molL-1min-1
molL-1min-1
B.其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,平衡时n(A)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1,则反应的ΔH<0
D.相同温度下,起始时向容器中充入0.15mol A和0.090mol B,平衡时A转化率小于88%