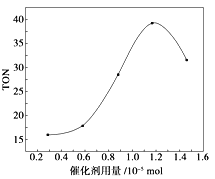
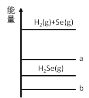
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
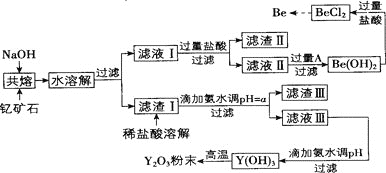
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石![]() ,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
已知:
![]() 钇
钇![]() 的常见化合价为
的常见化合价为![]() 价;
价;
![]() 铍和铝处于元素周期表的对角线位置,化学性质相似;
铍和铝处于元素周期表的对角线位置,化学性质相似;
![]() 、
、![]() 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2:1 | 3:1 |
Y3+ | 6.0 | 8.3 |
![]() 将钇矿石与NaOH共熔的反应方程式补充完整:
将钇矿石与NaOH共熔的反应方程式补充完整:
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]()
![]() 滤渣Ⅱ的主要成分是_________。
滤渣Ⅱ的主要成分是_________。
![]() 试剂A可以是_________
试剂A可以是_________![]() 填序号
填序号![]() 。
。
A NaOH溶液 ![]() 氨水
氨水 ![]()
![]()
![]() 用氨水调节
用氨水调节![]() 时,a的取值范围是_____________。
时,a的取值范围是_____________。
![]() 计算常温下
计算常温下![]() 的平衡常数
的平衡常数![]() ____________。
____________。![]() 常温下
常温下![]()
![]() 滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
![]() 从
从![]() 溶液中得到
溶液中得到![]() 固体的操作是_______。
固体的操作是_______。