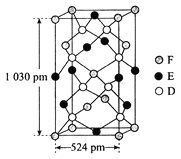
��Ŀ����
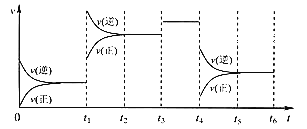
����Ŀ����֪��ӦX(g)��Y(g)![]() R(g)��Q(g)��ƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.2 mol X��0.8 mol Y����Ӧ��ʼ4 s��v(X)��0.005 mol/(L��s)������˵����ȷ����
R(g)��Q(g)��ƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.2 mol X��0.8 mol Y����Ӧ��ʼ4 s��v(X)��0.005 mol/(L��s)������˵����ȷ����
�¶�/�� | 700 | 800 | 830 | 1 000 | 1 200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 sʱ������c(Y)��0.76 mol/L
B. 830 ����ƽ��ʱ��X��ת����Ϊ80%
C. ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ�
D. 1 200 ��ʱ��ӦR(g)��Q(g) ![]() X(g)��Y(g)��ƽ�ⳣ��K��0.4
X(g)��Y(g)��ƽ�ⳣ��K��0.4
���𰸡�B
��������
����![]() (X)��0.005 mol/(L��s)����
(X)��0.005 mol/(L��s)����![]() (Y)��0.005 mol/(L��s)��4sY�ļ�����Ϊ0.02 mol/L��4 sʱ������c(Y)��0.78 mol/L��A�����830����ƽ��ʱ��ƽ�ⳣ��Ϊ1��Ӧ��c(X)��c(Y)=" c(R)" �� c(Q),����a mol/L��X���뷴Ӧ��������YΪa mol/L������Q��R�ֱ�Ϊa mol/L��(0.2-a)(0.8-a)=a2��a=0.16����0.16 mol/L��X���뷴Ӧ��ת����Ϊ80%��B����ȷ����Ӧ��ƽ��������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ���C�����1200��ʱ��ӦR(g)��Q(g)
(Y)��0.005 mol/(L��s)��4sY�ļ�����Ϊ0.02 mol/L��4 sʱ������c(Y)��0.78 mol/L��A�����830����ƽ��ʱ��ƽ�ⳣ��Ϊ1��Ӧ��c(X)��c(Y)=" c(R)" �� c(Q),����a mol/L��X���뷴Ӧ��������YΪa mol/L������Q��R�ֱ�Ϊa mol/L��(0.2-a)(0.8-a)=a2��a=0.16����0.16 mol/L��X���뷴Ӧ��ת����Ϊ80%��B����ȷ����Ӧ��ƽ��������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ���C�����1200��ʱ��ӦR(g)��Q(g)![]() X(g)��Y(g)��ƽ�ⳣ��K��1/0.4=2.5��D�����
X(g)��Y(g)��ƽ�ⳣ��K��1/0.4=2.5��D�����

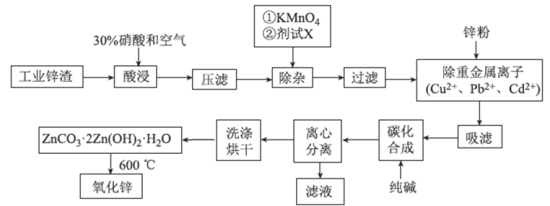
����Ŀ�������������������ܺͽ����ܵ�ԭ�ϡ�һ�����ú��ܷ��ϣ���Ҫ�ɷ�Co2O3����������Fe2O3��MnO2��Al2O3��CaO��MgO��̼���л���ȣ���ȡ������(CoC2O3)�Ĺ����������£�
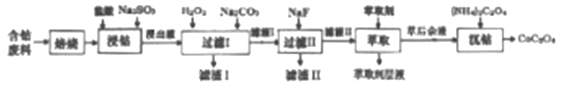
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȡ�
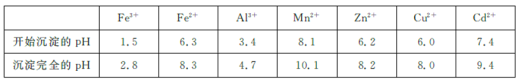
�ڲ���������һ����������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ����ʱ��pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��Kap(MgF2)=7.35��10-11��Kap(CaF2)=1.05��10-10
�ش��������⣺
(1)���յ�Ŀ����_________�����ܹ�����Co3+ת��ΪCo2+����Ӧ�����ӷ���ʽΪ_____________��
(2)����H2O2��Ŀ����__________������Na2CO3��Һ����pH��5.2����������Ҫ�ɷ�Ϊ__________��
(3)�������NaF��Һ���ɽ�Ca2+��Mg2+��ȥ����������Һ��c(Ca2+)=1.0��10-5mol��L-1������Һ��c(Mg2+)Ϊ_______________��
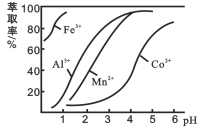
(4)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ��ʾ����Һ���м�����ȡ����������_________����ȡʱ����Һ��pH��Ҫ������һ����Χ�ڲűȽ����ˣ���pH��ΧԼΪ__________��
(5)��֪���ܷ����к�Co2O3��������Ϊa%����ȡmg�ú��ܷ��ϰ����������̣�������������Ƶ�CoC2O4������Ϊ__________g���г�����ʽ���ɣ���