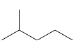
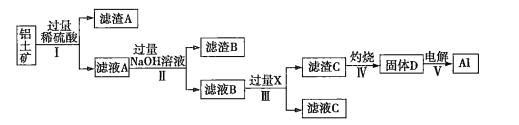
【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
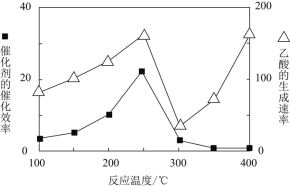
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: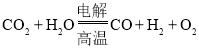 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
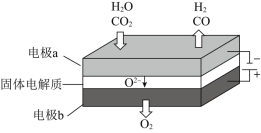
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
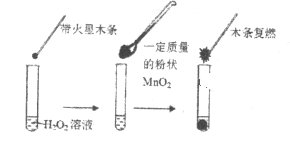
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴 0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。