【题目】化学小组同学为探究氯水的成分及性质进行了如下实验:
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
实验操作(氯水均为新制) |
|
|
|
|
|
实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
(试管中溶液均为1mL,均滴入氯水5滴)
(1)证明氯水中含有Cl-的是实验__(填序号),用离子方程式表示该实验中涉及的反应__。
(2)由实验②的现象可推断非金属性:Cl__I(填“>”或“<”),由原子结构解释其原因:Cl和I同主族,__,得电子能力:Cl>I(请补充完整)。
(3)实验③中溶液变红是由于溶液中含有__(填微粒符号,下同);使溶液褪色的微粒是__。
(4)同学们根据“H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不一定说明氧化性Cl2>H2O2。为证实Cl2将H2O2氧化,可继续补充实验:__(填操作、现象)。
(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。
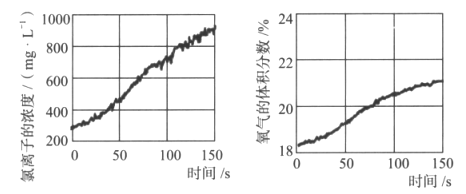
解释上两图中曲线变化的原因__。若在上述整个实验过程中测定溶液的pH,pH的变化是__。
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
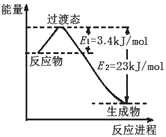
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:
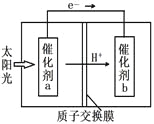
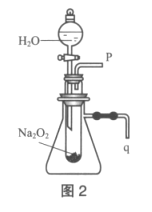
①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。
【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。
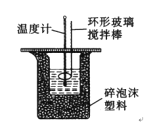
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度