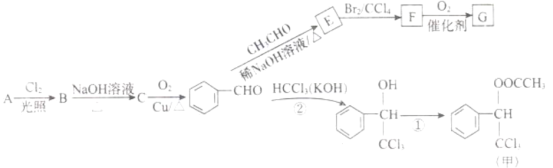
题目内容
【题目】煤气中主要的含硫杂质有![]() 以及
以及![]() 有机硫
有机硫![]() ,煤气燃烧后含硫杂质会转化成
,煤气燃烧后含硫杂质会转化成![]() 从而引起大气污染,因此煤气中
从而引起大气污染,因此煤气中![]() 的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
![]() 在水溶液中的电离方程式为______。
在水溶液中的电离方程式为______。![]() 只写第一级
只写第一级![]()
![]() 脱除煤气中COS的方法有
脱除煤气中COS的方法有![]() 的KOH溶液氧化法、
的KOH溶液氧化法、![]() 还原法、水解法等。
还原法、水解法等。
![]() 的分子结构与
的分子结构与![]() 相似,COS的结构式为______。
相似,COS的结构式为______。
![]() 的KOH溶液将COS氧化为硫酸盐的离子方程式为______。
的KOH溶液将COS氧化为硫酸盐的离子方程式为______。
![]() 已知:
已知:![]() 、COS、
、COS、![]() 、CO的燃烧热依次为
、CO的燃烧热依次为![]() 、
、![]() 、
、![]() 、
、![]() ;
;![]() 还原COS发生的反应为
还原COS发生的反应为![]() ,该反应的
,该反应的![]() ______
______![]() 。
。
![]() 用活性
用活性![]() 催化COS水解反应为
催化COS水解反应为![]() ,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率
,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率![]() 未达到平衡
未达到平衡![]() 如图1所示;某温度下,COS的平衡转化率与
如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
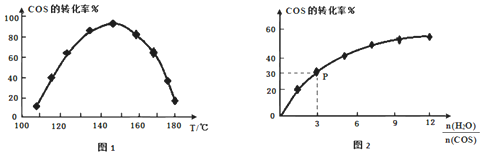
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是______。由图2可知,P点时平衡常数![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
【答案】![]()
![]()
![]()
![]()
![]() 催化剂中毒或发生副反应等
催化剂中毒或发生副反应等 ![]()
【解析】
![]() 在水溶液中,
在水溶液中,![]() 是二元弱酸,分步电离,用“
是二元弱酸,分步电离,用“![]() ”连接;
”连接;
![]() 和COS是等电子体,等电子体结构相似,根据二氧化碳的分子的结构式可知COS结构式;
和COS是等电子体,等电子体结构相似,根据二氧化碳的分子的结构式可知COS结构式;
![]() 的KOH溶液将COS氧化为硫酸盐,Br被还原为
的KOH溶液将COS氧化为硫酸盐,Br被还原为![]() ,COS中C的化合价为
,COS中C的化合价为![]() ,反应生成
,反应生成![]() ,据此书写离子方程式;
,据此书写离子方程式;
![]() 根据燃烧热的概念,再利用盖斯定律求出
根据燃烧热的概念,再利用盖斯定律求出![]() 还原COS的反应热;
还原COS的反应热;
![]() 的平衡转化率最大点对应的温度是催化剂活性最大时对应的温度;利用三段式计算平衡常数。
的平衡转化率最大点对应的温度是催化剂活性最大时对应的温度;利用三段式计算平衡常数。
![]() 是二元弱酸,电离方程式为
是二元弱酸,电离方程式为![]() ;
;
故答案为:![]() ;
;
![]() 根据二氧化碳分子的结构式可知:COS分子中C与O、C与S均形成两对共有电子对,所以COS结构式为:
根据二氧化碳分子的结构式可知:COS分子中C与O、C与S均形成两对共有电子对,所以COS结构式为:![]() ,
,
故答案为:![]() ;
;
![]() 和
和![]() 、KOH反应生成
、KOH反应生成![]() 、
、![]() 、
、![]() 和
和![]() ,所以反应的离子方程式为
,所以反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 、COS、
、COS、![]() 、CO燃烧热依次为
、CO燃烧热依次为![]() 、
、![]() 、
、![]() 、
、![]() ,反应为
,反应为![]() ,该反应的△H=(-
,该反应的△H=(-![]() )+(-
)+(-![]() )-(-
)-(-![]() )-(-
)-(-![]() )=-285kJ/mol,
)=-285kJ/mol,
故答案为:-285;
![]() 当温度为
当温度为![]() 时,COS的转化率最大;COS的转化率在后期下降的原因是催化剂中毒或发生副反应等;
时,COS的转化率最大;COS的转化率在后期下降的原因是催化剂中毒或发生副反应等;
开始时,设![]() ,则
,则![]() ,三段式有:
,三段式有:
则平衡常数 ;
;
故答案为:![]() ; 催化剂中毒,发生副反应等;
; 催化剂中毒,发生副反应等;![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】有如下反应:
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ②H++OH-=H2O |
③2Fe+3Cl2 | ④NaHCO3+NaOH=Na2CO3+H2O |
⑤CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | ⑥NaClO+CO2+H2O=HClO+NaHCO3 |
⑦2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | ⑧CO2+H2O=H2CO3 |
请回答:
(1)上述反应中有电子转移的是___(填序号),因此该类反应属于__反应。
(2)反应⑤的离子方程式是__。
(3)上述反应中属于复分解反应的是__(填序号)。复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,请补充反应:_(写一个符合条件的化学方程式或离子方程式)。
(4)由反应①及所学知识判断:在该反应发生的条件下,NO3-、H+、Cu2+的氧化性由大到小的顺序是___。