【题目】Ⅰ.测定化学反应速率
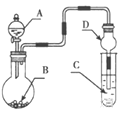
某同学利用如图装置测定化学反应速率。
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是__;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__。
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是___。
Ⅱ.为探讨化学反应速率的影响因素
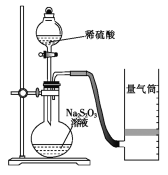
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。已知:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量 | 水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
体积/mL | 浓度/molL-1 | 体积/mL | 浓度/molL-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 1.0 | 0.010 | 4.0 | 25 | ||
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥__。
(2)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__mol·L-1·min-1。
(3)请完成表格内二处空白__、__。
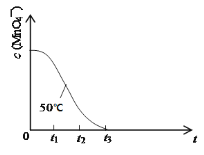
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。其中反应速率最快的阶段是__,原因是___。