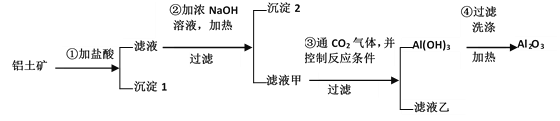
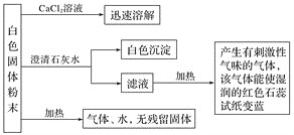
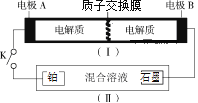
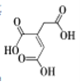
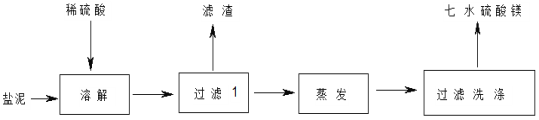
0 199486 199494 199500 199504 199510 199512 199516 199522 199524 199530 199536 199540 199542 199546 199552 199554 199560 199564 199566 199570 199572 199576 199578 199580 199581 199582 199584 199585 199586 199588 199590 199594 199596 199600 199602 199606 199612 199614 199620 199624 199626 199630 199636 199642 199644 199650 199654 199656 199662 199666 199672 199680 203614