题目内容
【题目】工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
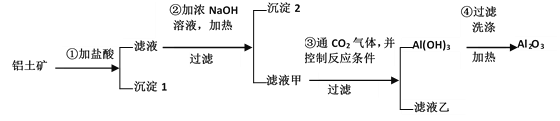
(1)写出步骤①中所发生反应的化学方程式____
(2)沉淀1是_________(写化学式);沉淀2是________(写化学式)。
(3)写出步骤②中所发生反应的离子方程式__________
(4)用氧化铝冶炼铝的化学方程式是______
(5)请设计另一个实验方案提取氧化铝________
【答案】Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O SiO2 Fe(OH)3 Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]- 2Al2O3![]() 4Al +3O2 ↑ ①为氢氧化钠时,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁;②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液;试剂③为氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝。
4Al +3O2 ↑ ①为氢氧化钠时,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁;②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液;试剂③为氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝。
【解析】
①为盐酸则在①得到滤液中含有铝离子、铁离子,滤渣(沉淀1)为二氧化硅;在滤液中加入浓氢氧化钠溶液并加热,除去铁离子,将铝离子转化为偏铝酸根,过滤得到沉淀2和滤液甲,则推出沉淀2为氢氧化铁,滤液甲为偏铝酸钠;向滤液甲中通入二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,同时生成碳酸氢钠或碳酸钠溶液,得到的氢氧化铝沉淀再通过过滤洗涤加热分解得氧化铝,据此分析作答。
根据上述工艺流程分析可知,
(1)步骤①中氧化铝与氧化铁均会被盐酸溶解,所发生反应的化学方程式分别为Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(2)沉淀1是SiO2;沉淀2是Fe(OH)3;
(3)步骤②为氯化铁与氢氧化钠反应生成沉淀,同时氯化铝与氢氧化钠反应生成偏铝酸钠与水的过程,所发生反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-(或Al3++4OH-=AlO2-+2H2O);
(4)工业上通过冶炼氧化铝可得到铝单质,其化学方程式为:2Al2O3![]() 4Al +3O2 ↑;
4Al +3O2 ↑;
(5)氧化铝是两性氧化物,既溶液强酸又溶于强碱,而Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸。上述工艺流程若①为氢氧化钠时,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁;②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液;试剂③为氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。