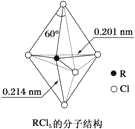
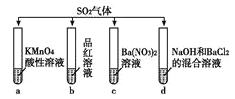
【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
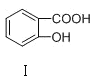
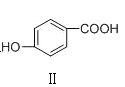
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D
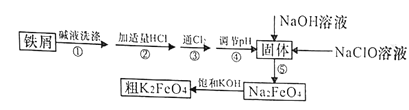
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。