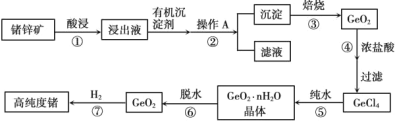
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 |
|
| HClO |
|
|
电离平衡常数 |
|
|
|
|
|
(1)25℃时,等浓度的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,3种溶液的pH由大到小的顺序为________。
溶液,3种溶液的pH由大到小的顺序为________。
(2)工业上可用氨水除去尾气![]() 。将
。将![]() 通入氨水中,当
通入氨水中,当![]() 降至
降至![]() _____。
_____。
(3)常温下,用![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图:
溶液所得滴定曲线如图:
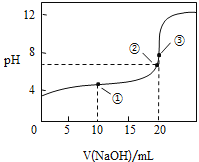
①在整个实验过程中,不需要的仪器或用品是 ______(填序号).
![]() 容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
②到达滴定终点的标志是 _____________ .
③下列操作会导致测定结果偏高的是 ______ .
A 碱式滴定管在装液前未用标准NaOH溶液润洗
B 滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C 碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D 达到滴定终点时,仰视读数
④如图点①所示溶液中![]() __________
__________![]() 填“>”“<”或“=”,下同,点②所示溶液中:
填“>”“<”或“=”,下同,点②所示溶液中:![]() ________
________![]() ,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
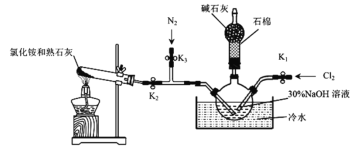
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)