【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
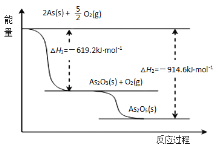
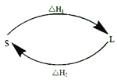
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
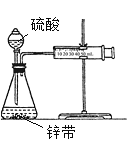
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。