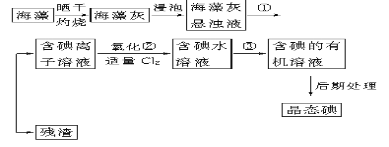
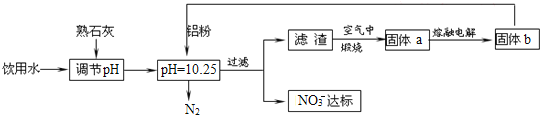
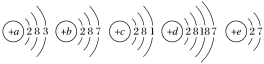【题目】某校化学研究小组会试对校园附近空气质量进行测定请回答下列问题。
(1)甲组同学设计了如图所示的实验装置,对空气中SO2、悬浮颗粒物含量进行测定。下列装置连接的顺序为(填序号 )________________。

注:气体流速管是用来测量单位时间内通过气体的体积的装置
①用上述装置定量测定空气中的SO2和可吸入颗粒的含量,除测定气体流速(单位:cm3·min-1)外还需要测定____________、____________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。请你协助甲组同学完成100mL 5×10-4mo1 L-1碘溶液的配制:
第一步:用电子天平准确称取1.27g碘单质加入烧杯中,______________。
第二步:将第一步所得溶液和洗涤液全部转入_____ mL的容量瓶中,加水定容,摇匀。
第三步:从第二步所得溶液中取出10.00mL溶液倒入100mL容量瓶中,加水稀释至刻度线,摇匀。
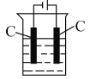
(2)乙组同学拟用如图简易装置测定空气中的SO2含量:

①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃管的下端浸没在水中)。然后__________(填写操作方法)时。将会看到_____________(填写实验现象),则证明该装置的气密性良好。
②测定指定地点空气中的SO2含量准确移取1.00mL 5×10-4mo1L-1碘溶液,注入如图所示试管中。用适量的蒸馏水桸释后,再加2~3滴淀粉溶液,配制成溶液A。甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
分组 | 甲组 | 乙组 |
抽气次数 | 110 | 145 |
我国环境空气质量标准对空气质量测定中SO2的最高浓度限值如下表:
最高浓度限值/mg·m-3 | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0. 70 |
经老师和同学们分析,判断甲组测定结果更为准确,则该地点的空气中SO2 的含量为_______mgm-3(保留2 位有效数字),属于________(填汉字)级标准;请你分析乙组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)______________。
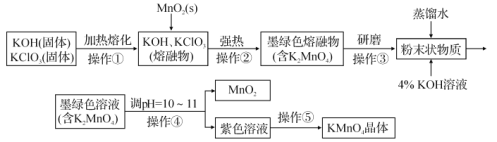
【题目】二烯烃与溴反应制备多卤代物,反应的区域选择性在有机合成中具有重要意义。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反应原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列问题:
(1)△H3=_____________。
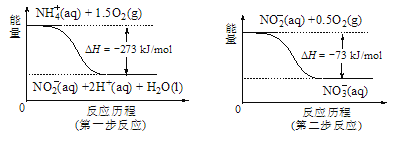
(2)1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为_________
(3)T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成产物 | 0% | 26% | 10% | 4% | 4% |
1,4加成产物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=_______。
(4)对于反应③,若要提高1,4-加成产物 ( )平衡体系中的物质量分数,可以采取的措施有_____
)平衡体系中的物质量分数,可以采取的措施有_____
A.适当升高温度 B.使用合适的催化剂
C.增大体系的压强 D.将1,4加成产物及时从体系分离
(5)反应 1,3-丁二烯二聚体的解聚为可逆反应:
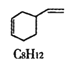 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
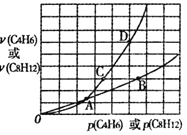
在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_____;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是______ ,理由是________。