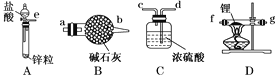
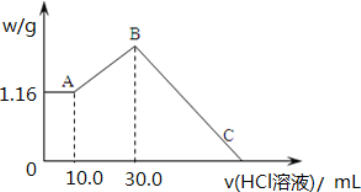
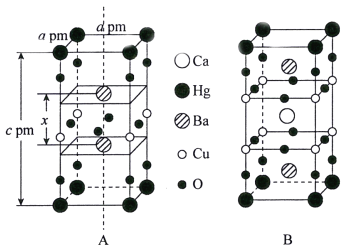
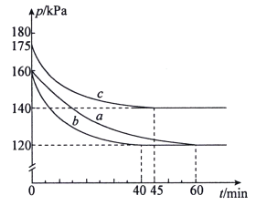
0 198125 198133 198139 198143 198149 198151 198155 198161 198163 198169 198175 198179 198181 198185 198191 198193 198199 198203 198205 198209 198211 198215 198217 198219 198220 198221 198223 198224 198225 198227 198229 198233 198235 198239 198241 198245 198251 198253 198259 198263 198265 198269 198275 198281 198283 198289 198293 198295 198301 198305 198311 198319 203614