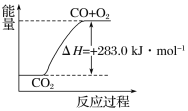
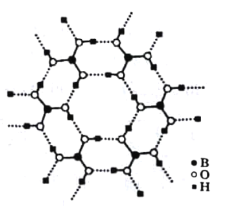
ЬтФПФкШн
ЁОЬтФПЁПЃЈ1ЃЉзюНќВФСЯПЦбЇМвЗЂЯжСЫЪзР§ДјНсОЇЫЎЕФОЇЬхдк5KЯТГЪЯжГЌЕМадЁЃИУОЇЬхЕФЛЏбЇЪНЮЊNa0.35CoO2ЁЄ1.3H2O(ИУОЇЬхЕФФІЖћжЪСПЮЊ122gЁЄmol-1)ЃЌШєгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЃЌдђ12.2gИУОЇЬхжаКЌбѕдзгЪ§ЮЊ___ЃЌЧтдзгЕФЮяжЪЕФСПЮЊ___molЁЃ
ЃЈ2ЃЉFeCl3ШмвКПЩвдгУРДОЛЫЎЃЌгУ100mL2molЁЄL-1ЕФFeCl3ШмвКОЛЫЎЪБЃЌЩњГЩОпгаОЛЫЎзїгУЕФЮЂСЃЪ§___(ЬюЁАДѓгкЁБЁАЕШгкЁБЛђЁАаЁгкЁБ)0.2NAЁЃ
ЃЈ3ЃЉдкБъзМзДПіЯТЃЌVLФГЦјЬх(ФІЖћжЪСПЮЊMg/mol)ШмНтдк1LЫЎ(ЫЎЕФУмЖШНќЫЦЮЊ1g/cm3)жаЃЌМйЩшЦјЬхЭъШЋШмНтЧвВЛгыЫЎЗЂЩњЗДгІЃЌЫљЕУШмвКЕФУмЖШЮЊІбg/cm3ЃЌдђЫљЕУШмвКЕФЮяжЪЕФСПХЈЖШc=___mol/L(гУвдЩЯзжФИБэЪОЃЌЧвБиаыЛЏМђ)ЁЃ
ЃЈ4ЃЉЙЄвЕЩЯгУбЧТШЫсФЦКЭЯЁбЮЫсЮЊдСЯжЦБИClO2ЗДгІЃКNaClO2ЃЋHClЁњClO2ЁќЃЋNaCl+H2OЁЃаДГіХфЦНЕФЛЏбЇЗНГЬЪН____ЁЃ
ЃЈ5ЃЉЯђ100mLЕФFeBr2ШмвКжаЭЈШыБъзМзДПіЯТCl23.36L(вбжЊЛЙдадЃКFe2ЃЋЃОBrЃ)ЃЌЗДгІКѓЕФШмвКжаClЃКЭBrЃЕФЮяжЪЕФСПХЈЖШЯрЕШЃЌдђдFeBr2ШмвКЕФЮяжЪЕФСПХЈЖШЮЊ____mol/LЁЃЗДгІЕФРызгЗНГЬЪНЮЊ____ЁЃ
ЃЈ6ЃЉШєЯђЪЂга10mL1molЁЄLЃ1NH4Al(SO4)2ШмвКЕФЩеБжаМг20mL1.2molЁЄLЃ1Ba(OH)2ШмвКЃЌГфЗжЗДгІКѓЃЌШмвКжаВњЩњГСЕэЕФЮяжЪЕФСПЮЊ____molЁЃ
ЁОД№АИЁП0.33NA 0.26 аЁгк ![]() 5NaClO2ЃЋ4HCl=4ClO2ЁќЃЋ5NaCl+2H2O 2 4Fe2ЃЋЃЋ2Br-ЃЋ3Cl2=4Fe3ЃЋЃЋBr2ЃЋ3Cl- 0.022
5NaClO2ЃЋ4HCl=4ClO2ЁќЃЋ5NaCl+2H2O 2 4Fe2ЃЋЃЋ2Br-ЃЋ3Cl2=4Fe3ЃЋЃЋBr2ЃЋ3Cl- 0.022
ЁОНтЮіЁП
ЃЈ1ЃЉИљОн![]() МЦЫуОЇЬхЕФЮяжЪЕФСПЃЌНјЖјМЦЫубѕдзгЁЂЧтдзгЕФЮяжЪЕФСПЃЛ
МЦЫуОЇЬхЕФЮяжЪЕФСПЃЌНјЖјМЦЫубѕдзгЁЂЧтдзгЕФЮяжЪЕФСПЃЛ
ЃЈ2ЃЉ100mL2molЁЄL-1ЕФFeCl3ШмвКжаFeCl3ЕФЮяжЪЕФСПЪЧ0.1LЁС2molЁЄL-1=0.2molЁЃ
ЃЈ3ЃЉИљОнЮяжЪЕФСПХЈЖШЕФМЦЫуЙЋЪН![]() МЦЫуЃЛ
МЦЫуЃЛ
ЃЈ4ЃЉИљОнЕУЪЇЕчзгЪиКуЁЂдЊЫиЪиКуХфЦНЗНГЬЪНЁЃ
ЃЈ5ЃЉЛЙдадЃКFe2ЃЋЃОBrЃЃЌFeBr2ШмвКжаЭЈШыБъзМзДПіЯТCl2ЃЌТШЦјЯШбѕЛЏFe2ЃЋЃЛ
ЃЈ6ЃЉNH4Al(SO4)2гыBa(OH)2ШмвКЛьКЯЃЌSO42-ЁЂBa2+ЗДгІЩњГЩBaSO4ГСЕэЃЌOH-гыAl3+ЁЂNH4+вРДЮЗЂЩњЗДгІAl3++3OH-=Al(OH)3Ё§ЁЂNH4++OH-=NH3H2OЁЂAl(OH)3+OH-=AlO2-+2H2OЁЃ
ЃЈ1ЃЉИљОн![]() ЃЌ12.2gИУОЇЬхЕФЮяжЪЕФСПЪЧ
ЃЌ12.2gИУОЇЬхЕФЮяжЪЕФСПЪЧ![]() 0.1molЃЌКЌбѕдзгЪ§ЮЊ0.1ЁС3.3ЁСNA=0.33NAЃЌЧтдзгЕФЮяжЪЕФСПЮЊ0.1molЁС2.6=0.26molЃЛ
0.1molЃЌКЌбѕдзгЪ§ЮЊ0.1ЁС3.3ЁСNA=0.33NAЃЌЧтдзгЕФЮяжЪЕФСПЮЊ0.1molЁС2.6=0.26molЃЛ
ЃЈ2ЃЉ100mL2molЁЄL-1ЕФFeCl3ШмвКжаFeCl3ЕФЮяжЪЕФСПЪЧ0.1LЁС2molЁЄL-1=0.2molЃЌЩњГЩОпгаОЛЫЎзїгУЕФЮЂСЃЪЧЧтбѕЛЏЬњНКСЃЃЌЧтбѕЛЏЬњНКСЃЪЧЧтбѕЛЏЬњЕФОлМЏЬхЃЌЫљвдЮЂСЃЪ§аЁгк0.2NAЁЃ
ЃЈ3ЃЉдкБъзМзДПіЯТЃЌVLФГЦјЬхЕФЮяжЪЕФСПЪЧ![]() ЃЛVLФГЦјЬхЕФжЪСПЪЧ
ЃЛVLФГЦјЬхЕФжЪСПЪЧ![]() ЃЛЫљЕУШмвКЕФжЪСПЪЧ
ЃЛЫљЕУШмвКЕФжЪСПЪЧ![]() ЃЌШмвКЕФЬхЛ§ЪЧ
ЃЌШмвКЕФЬхЛ§ЪЧ ЃЌЫљвдЮяжЪЕФСПХЈЖШЮЊ
ЃЌЫљвдЮяжЪЕФСПХЈЖШЮЊ![]() ЁТ
ЁТ![]() =
=![]() mol/LЃЛ
mol/LЃЛ
ЃЈ4ЃЉNaClO2жаВПЗжТШдЊЫиЛЏКЯМлгЩ+3Щ§ИпЮЊ+4ЁЂВПЗжТШдЊЫиЛЏКЯМлгЩ+3НЕЕЭЮЊ-1ЃЌЫљвдNaClO2МШЪЧбѕЛЏМСгжЪЧЛЙдМСЃЌИљОнЕУЪЇЕчзгЪиКуЃЌбѕЛЏМСЛЙдМСЕФБШЮЊ1:4ЃЌЫљвдЗДгІЗНГЬЪНЪЧ5NaClO2ЃЋ4HCl=4ClO2ЁќЃЋ5NaCl+2H2OЁЃ
ЃЈ5ЃЉЛЙдадЃКFe2ЃЋЃОBrЃЃЌFeBr2ШмвКжаЭЈШыCl2ЃЌТШЦјЯШбѕЛЏFe2ЃЋЃЛБъзМзДПіЯТ3.36L Cl2ЕФЮяжЪЕФСПЪЧ![]() 0.15molЃЌЩшFeBr2ЕФЮяжЪЕФСПЮЊxmolЃЌТШЦјгыFe2ЃЋЗДгІЕФРызгЗНГЬЪНЪЧ2Fe2ЃЋ+Cl2=2Fe3ЃЋ+2Cl-ЃЌдђFe2ЃЋЯћКФТШЦјЕФЮяжЪЕФСПЪЧ
0.15molЃЌЩшFeBr2ЕФЮяжЪЕФСПЮЊxmolЃЌТШЦјгыFe2ЃЋЗДгІЕФРызгЗНГЬЪНЪЧ2Fe2ЃЋ+Cl2=2Fe3ЃЋ+2Cl-ЃЌдђFe2ЃЋЯћКФТШЦјЕФЮяжЪЕФСПЪЧ![]() molЃЛгыBr-ЗДгІЕФТШЦјЮяжЪЕФСПЪЧ0.15mol-
molЃЛгыBr-ЗДгІЕФТШЦјЮяжЪЕФСПЪЧ0.15mol-![]() molЃЌТШЦјгыBr-ЗДгІЕФРызгЗНГЬЪНЪЧ2Br-+Cl2=Br2+2Cl-ЃЌЪЃгрBr-ЕФЮяжЪЕФСПЪЧ2x-0.3+x=(3x-0.3)molЃЌИљОнТШдЊЫиЪиКуЃЌЗДгІКѓШмвКжаCl-ЕФЮяжЪЕФСПЪЧ0.3molЃЌЗДгІКѓЕФШмвКжаClЃКЭBrЃЕФЮяжЪЕФСПХЈЖШЯрЕШЃЌдђ3x-0.3=0.3ЃЌx=0.2molЃЛдFeBr2ШмвКЕФЮяжЪЕФСПХЈЖШЮЊ0.2molЁТ0.1L=2mol/LЃЛгыBr-ЗДгІЕФТШЦјЮяжЪЕФСПЪЧ0.15mol-
molЃЌТШЦјгыBr-ЗДгІЕФРызгЗНГЬЪНЪЧ2Br-+Cl2=Br2+2Cl-ЃЌЪЃгрBr-ЕФЮяжЪЕФСПЪЧ2x-0.3+x=(3x-0.3)molЃЌИљОнТШдЊЫиЪиКуЃЌЗДгІКѓШмвКжаCl-ЕФЮяжЪЕФСПЪЧ0.3molЃЌЗДгІКѓЕФШмвКжаClЃКЭBrЃЕФЮяжЪЕФСПХЈЖШЯрЕШЃЌдђ3x-0.3=0.3ЃЌx=0.2molЃЛдFeBr2ШмвКЕФЮяжЪЕФСПХЈЖШЮЊ0.2molЁТ0.1L=2mol/LЃЛгыBr-ЗДгІЕФТШЦјЮяжЪЕФСПЪЧ0.15mol-![]() mol=0.05molЃЌБЛбѕЛЏЕФBr-ЕФЮяжЪЕФСПЪЧ0.1molЃЌБЛбѕЛЏЕФFe2ЃЋЁЂBr-ЕФЮяжЪЕФСПБШЪЧ2:1ЃЌЫљвдЗДгІЗНГЬЪНЪЧ4Fe2ЃЋЃЋ2Br-ЃЋ3Cl2=4Fe3ЃЋЃЋBr2ЃЋ3Cl-ЃЛ
mol=0.05molЃЌБЛбѕЛЏЕФBr-ЕФЮяжЪЕФСПЪЧ0.1molЃЌБЛбѕЛЏЕФFe2ЃЋЁЂBr-ЕФЮяжЪЕФСПБШЪЧ2:1ЃЌЫљвдЗДгІЗНГЬЪНЪЧ4Fe2ЃЋЃЋ2Br-ЃЋ3Cl2=4Fe3ЃЋЃЋBr2ЃЋ3Cl-ЃЛ
ЃЈ6ЃЉ10mL 1molL-1NH4Al(SO4)2ШмвКжаAl3+ЮяжЪЕФСПЮЊ0.01molЃЌNH4+ЕФЮяжЪЕФСПЮЊ0.01molЃЌSO42-ЕФЮяжЪЕФСПЮЊ0.02molЃЌ20mL 1.2 molL-1Ba(OH)2ШмвКжаBa2+ЮяжЪЕФСПЮЊ0.024molЃЌOH-ЮЊ0.048molЃЛгЩSO42-+Ba2+=BaSO4Ё§ЃЌПЩжЊSO42-ВЛзуЃЌЫљвдПЩвдЕУЕН0.02mol BaSO4ЃЛИљОнAl3++3OH-=Al(OH)3Ё§ПЩжЊЗДгІЪЃгрOH-ЮЊ0.048mol-0.03mol=0.018molЃЌИљОнH4++OH-=NH3H2OПЩжЊЗДгІЪЃгрOH-ЮЊ0.018mol-0.01mol=0.008molЃЌИљОнAl(OH)3+OH-=AlO2-+2H2OПЩжЊЕУЕНAl(OH)3ГСЕэЮЊ0.01mol-0.008mol=0.002molЃЌдђзюжеЕУЕНЙЬЬхЮЊ0.02mol+0.002mol=0.022molЁЃ

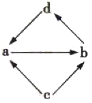
ЁОЬтФПЁПЯТБэжаЕФИїзщЮяжЪжЎМфЭЈЙ§вЛВНЗДгІОЭФмЪЕЯжШчЭМЫљЪОзЊЛЏЕФЪЧЃЈ ЃЉ
БрКХ | a | b | c | d |
|
Ђй | Na2O | Na2O2 | Na | NaOH | |
Ђк | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
Ђл | FeCl2 | FeCl3 | Fe | CuCl2 | |
Ђм | MgO | MgCl2 | Mg | Mg(OH)2 |
A.ЂйЂкЂмB.ЂйЂлЂмC.ЂйЂкЂлD.ЂкЂлЂм