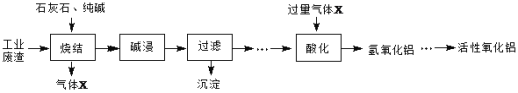
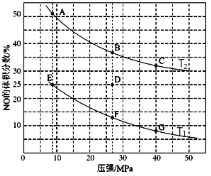
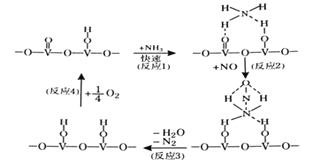
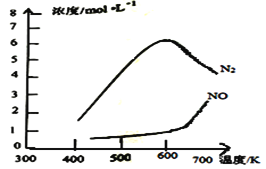
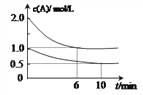
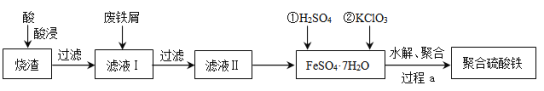
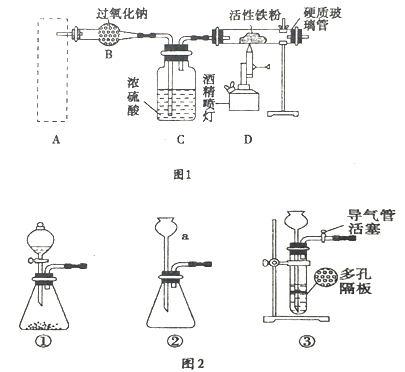
0 197451 197459 197465 197469 197475 197477 197481 197487 197489 197495 197501 197505 197507 197511 197517 197519 197525 197529 197531 197535 197537 197541 197543 197545 197546 197547 197549 197550 197551 197553 197555 197559 197561 197565 197567 197571 197577 197579 197585 197589 197591 197595 197601 197607 197609 197615 197619 197621 197627 197631 197637 197645 203614